时间:2020-08-23 05:52:57
1、选择题 已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应2S2Cl2+2H2O→4HCl+SO2↑+3S↓。在该反应中
A.S2Cl2既作氧化剂又作还原剂
B.氧化产物与还原产物物质的量比为3:1
C.每生成22.4L SO2转移3mol电子
D.每生成48g硫会断裂6mol共价键
参考答案:A
本题解析:A. 由二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl可知,其中的S的化合价为+1价,在反应后的生成物SO2中化合价为+4价,化合价升高,失去电子,作还原剂;在S单质中化合价为0价,化合价降低,得到电子,作氧化剂。因此S2Cl2既作氧化剂又作还原剂。正确。B. 根据方程式2S2Cl2+ 2H2O=4HCl+SO2↑+3S↓可知氧化产物SO2与还原产物S的物质的量的比为1:3。错误。C.每生成1molSO2转移3mol电子。但1mol SO2的体积只有在标准状况下才可能为22.4L。没有说明条件,所以体积大小无意义。错误。D.由方程式可知每生成3mol的 S会断裂6mol共价键,若产生48g硫及48÷32g/mol =1.5mol,所以会断裂3mol共价键。错误。
本题难度:一般
2、选择题 下列有关σ键和π键的说法错误的是
[? ]
A.含有π键的分子在反应时,π键是化学反应的积极参与者
B.当原子形成分子时,首先形成σ键,可能形成π键
C.有些原子在与其他原子形成分子时只能形成σ键,不能形成π键
D.在分子中,化学键可能只有π键而没有σ键
参考答案:D
本题解析:
本题难度:简单
3、简答题 m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:
(1)元素n的气态氢化物的电子式为______
(2)m与y所形成的化合物含______键
(3)x的原子结构示意图为______
(4)由n、y的氢化物相互作用所生成的物质的化学式为______.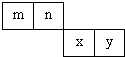
参考答案:m、n、x、y四种主族元素,它们的原子序数总和为46,平均原子序数为464=11.5,由4种元素在周期表里的相对位置可知,m、n处于第二周期,x、y处于第三周期,令n的原子序数为a,则m的原子序数为a-1,x原子序数为a+9,y原子序数为a+10,则a-1+a+a+9+a+10=46,解得a=7,则m为C、n为N、x为S、y为Cl,
(1)元素n的气态氢化物为NH3,其电子式为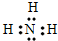 ,故答案为:
,故答案为: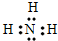 ;
;
(2)m与y所形成的化合物为CCl4,含极性键,故答案为:极性;
(3)S的原子结构示意图为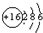 ,故答案为:
,故答案为: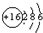 ;
;
(4)由n、y的氢化物相分别为NH3、HCl,互作用所生成的物质的化学式为NH4Cl,故答案为:NH4Cl.
本题解析:
本题难度:一般
4、选择题 X、Y、Z、M是4种短周期元素,其中X、Y位于同一主族,Y与M,X与Z位于同一周期.X原子最外层电子数是其电子层数的3倍.Z原子的核外电子数比X原子少1.M是同周期中半径最大的元素(除稀有气体元素),下列说法正确的是( )
A.Y元素最高价氧化物对应水化物的化学式可表示为HYO3
B.氢化物的稳定性Z>X>Y
C.X、Y、Z元素的气态氢化物中,Y的沸点最高
D.四种元素简单离子的半径由大到小依次为Y>Z>X>M
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列微粒空间构型为平面三角形的是( )?
A.NF3
B.HCHO?
C.PCl3
D.H3O+
参考答案:B?
本题解析:HCHO中的C原子采取的是sp2杂化,三个杂化轨道呈平面三角形,2个sp2杂化轨道分别与一个H原子形成一个C-Hσ键,另一个sp2杂化轨道与O原子形成一个σ键,C原子中未用于杂化的p轨道与O原子的p轨道形成一个π键,空间构型为平面三角形。NF3、PCl3、H3O+中心原子均采取sp3杂化,4个杂化轨道呈正四面体形,由于3个杂化轨道形成化学键,有1个杂化轨道被孤对电子占据,所以分子空间构型为三角锥形。?
本题难度:一般