时间:2020-08-13 07:17:20
1、填空题 (10分)(I)在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气;则
(1) 烧杯中放入锌的质量大(填甲或乙);
(2) 烧杯中的酸过量(填甲或乙);
(3)反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+) (填大或小)
(II)物质的量浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和等质量的Zn反应,则下列说法正确的是:
①产生的H2质量一定相同 ②产生H2的质量一定不同
③仅有一份溶液中存在锌,则一定是盐酸 ④等倍数稀释后的反应速率A>B
⑤产生等量H2所需时间A>B ⑥产生等量H2,盐酸和醋酸一定都有剩余
(III)向体积都为1L,pH都等于2的盐酸和醋酸溶液中投入0.3g Zn,则下图中比较符合客观事实的曲线是_________________。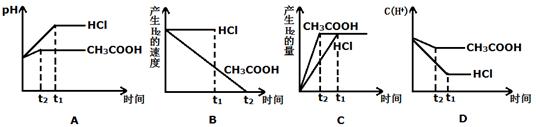
参考答案:(I)(1)甲(2)乙(3)大(II)① ④ (III)ACD
本题解析:(I)(1)在体积和pH都相等的盐酸和醋酸中,已提供的氢离子的浓度和物质的量相等,但由于醋酸是弱电解质,只有部分电离,所以可提供的氢离子的物质的量是醋酸的多,与锌反应时生成的氢气一样多,则醋酸中锌的质量应该较小,盐酸中锌的质量较大,故选甲。(2)因为醋酸的物质的量比盐酸的物质的量大,故醋酸过量,选乙。(3)反应开始后,醋酸中的分子继续电离,故氢离子浓度比盐酸中的氢离子浓度大。(II)物质的量浓度与体积都相等的盐酸和醋酸物质的量相等,加入等质量的锌,所以产生的氢气的量一定相同,①正确;②③错误;等倍数稀释,由于醋酸是弱电解质,不完全电离,盐酸时强电解质,完全电离,故盐酸中氢离子浓度远远大于醋酸中氢离子浓度,故盐酸的速率快,④正确;所以生成等量的氢气所需要的时间盐酸要少,⑤错误;生成等量的氢气,盐酸和醋酸可能都完全反应,也可能都有剩余,故⑥错误。故选①④。 (III)因为醋酸是弱电解质,存在电离平衡,所以反应过程中还可以继续电离出氢离子,故氢离子浓度大,pH小于盐酸中的pH,醋酸反应速率快,先结束反应,故AD正确;B错误;因为根据化学方程式可知,酸有剩余,故反应生成的氢气的量由锌决定,二者生成的氢气的量相等,醋酸的快些,故C正确;所以选ACD.
考点:强弱电解质的比较,电离平衡的移动,pH的比较。
本题难度:一般
2、填空题 (10分)(1)写出下列物质的电离方程式:
①H2S:
②NaHCO3溶于水: ③NaHSO4溶于水:
(2)下出下列盐的水解方程式(离子方程式):
①NH4Cl:
②明矾净水原理(只写相应离子的水解方程式):
③泡沫灭火器(硫酸铝和碳酸氢钠)的灭火原理:
(3)写出难溶电解质的溶度积表达式。Mg(OH)2:
(4)下出下列反应方程式:
①钢铁发生吸氧腐蚀的正极反应式:
②氢氧燃料电池,H2SO4做电解质溶液,正极反应式:
③电解饱和食盐水的总反应方程式:
参考答案:略
本题解析:略
本题难度:一般
3、填空题 (1)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的比值关系为 。
(2)现有浓度均为0.1 mol/L的下列溶液:①氢氧化钡;②醋酸;③氢氧化钠;④盐酸,四种溶液中由水电离出的OH—浓度由大到小的顺序是(填序号) 。
(3)已知100℃ KW=10-12,若将此温度下pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积之比为 。
参考答案:(1) V(酸):V(碱)=1:100 (2) ②>③=④>① (3)2:9
本题解析:(1)常温下某强酸溶液pH=a,则溶液中氢离子浓度是10-amol/L。强碱溶液pH=b,则溶液中OH-浓度是10b-14mol/L。已知酸碱溶液混合pH=7,则V(酸)×10-amol/L=V(碱)×10b-14mol/L。又因为a+b=12,所以V(酸):V(碱)=10a+b-14=10-2=1:100。
(2)氢氧化钡是二元强碱,则溶液中OH-浓度是0.2mol/L;醋酸是弱酸,存在电离平衡,则溶液中氢离子浓度是小于0.1mol/L;氢氧化钠是一元强碱,则溶液中OH-浓度是0.1mol/L;盐酸是一元强酸,则溶液中氢离子浓度是0.1mol/L。一元酸电离出的氢离子或碱电离出的OH-抑制水的电离,且氢离子或OH-浓度越大,抑制程度越大。因此四种溶液中由水电离出的OH—浓度由大到小的顺序是②>③=④>①。
(3)已知100℃ KW=10-12,则此温度下pH=8的Ba(OH)2溶液中OH-浓度是10-4mol/L。pH=5的稀盐酸溶液中氢离子浓度是10-5mol/L,如果混合后溶液的pH=7,这说明碱是过量的,所以有 =10-5mol/L,解得V(碱):V(酸)=2:9。
=10-5mol/L,解得V(碱):V(酸)=2:9。
考点:考查水的电离、溶液pH的计算
本题难度:一般
4、选择题 25℃的下列溶液中,碱性最强的是 ( )
A.pH = 11的溶液
B.c(OH-) =" 0.12" mol/L的溶液
C.1L中含有4 g NaOH的溶液
D.c(H+) = 1×10-10 mol/L的溶液
参考答案:B
本题解析:
c(OH-)分别为:A 10
本题难度:简单
5、选择题 下列溶液一定呈中性的是
A.pH=7的溶液
B.c(H+)=c(OH-)=10-6 mol·L-1的溶液
C.使石蕊试液呈紫色的溶液
D.酸与碱恰好完全反应生成正盐的溶液
参考答案:B
本题解析:A、pH=7的溶液,不一定是常温下,水的离子积不一定是Kw=1×10-14,溶液中c(H+)、c(OH-)不一定相等,PH不一定为7,A错误;B、溶液呈酸碱性本质,取决与溶液中H+浓度与OH-浓度的相对大小,溶液中c(H+)=c(OH-),溶液一定显示中性,B正确;C、石蕊的变色范围是5.0-8.0,使石蕊试液呈紫色的溶液有可能显酸性、中性或弱碱性,C错误;D、生成的正盐若是强酸强碱盐则呈中性,强酸弱碱盐呈酸性,强碱弱酸盐呈碱性,弱酸弱碱盐酸碱性无法确定,D错误;答案选B。
考点:考查水的电离。
本题难度:一般