时间:2020-08-13 07:17:20
1、选择题 下列各组比较中,前者比后者大的是
[? ]
A.25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度
B.25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度
C.同温度、同浓度的NaCl溶液和氨水的导电能力
D.25℃时,pH均为3的盐酸和FeCl3溶液中水的电离程度
参考答案:C
本题解析:
本题难度:一般
2、简答题 写出下列物质在水溶液里的电离方程式:
(1)硫酸铁______;
(2)氢氧化钡______.
参考答案:(1)硫酸铁是强电解质,能完全电离,电离方程式为Fe2(SO4)3=2Fe3++3SO42-,故答案为:Fe2(SO4)3=2Fe3++3SO42-;
(2)氢氧化钡是强电解质,能完全电离,电离方程式为Ba(OH)2=Ba2++2OH-,故答案为:Ba(OH)2=Ba2++2OH-.
本题解析:
本题难度:一般
3、选择题 某氨水的pH=a,某盐酸的pH=b,已知a+b=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是
A.c(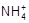 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
B.c(Cl-)>c(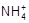 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.c(Cl-)>c(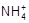 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.c(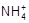 )+c(H+)=c(Cl-)+c(OH-)
)+c(H+)=c(Cl-)+c(OH-)
参考答案:D
本题解析:氨水和盐酸发生中和反应生成氯化铵和水,则根据电荷守恒可知c(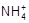 )+c(H+)=c(Cl-)+c(OH-),所以选项D正确,AB不正确;由于氨水是弱碱,且a+b=14,所以在反应中氨水是过量的,溶液显碱性,应该是c(
)+c(H+)=c(Cl-)+c(OH-),所以选项D正确,AB不正确;由于氨水是弱碱,且a+b=14,所以在反应中氨水是过量的,溶液显碱性,应该是c(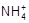 )>c(Cl-)>c(OH-)>c(H+),C不正确,答案选D。
)>c(Cl-)>c(OH-)>c(H+),C不正确,答案选D。
考点:考查酸碱中和后溶液酸碱性以及离子浓度大小比较
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确酸碱中和后溶液酸碱性的判断,首先要判断酸碱的过量问题。只有当酸碱恰好反应时,才能考虑生成的盐是否水解,其次要利用好电荷守恒、物料守恒以及质子守恒。
本题难度:困难
4、填空题 (12分)(1)氯化铁水解的离子方程式为 ,向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为 。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是白色沉淀转变为红褐色沉淀。产生该现象的原因是 。
(3)25℃,向100mL pH=12的NaOH溶液加入pH=10的NaOH溶液1000 mL,混合后溶液体积1100 mL ,pH= 。
(4)常温下,将0.1000 mol L-1 NaOH溶液滴入20.00 mL 0.1000 mol L-1的一元弱酸HA溶液中,刚好完全反应,则c(Na+) c(A-)。(填“>”、“<”或“=”)
(5)某有机物结构为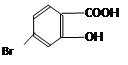 ,它的含氧官能团名称为 、 。
,它的含氧官能团名称为 、 。
参考答案:(1) Fe3+ + 3H2O  Fe(OH)3 + 3H+(2分)
Fe(OH)3 + 3H+(2分)
Fe3+ + 3HCO3- = Fe(OH)3 ↓ +3CO2 ↑(2分)
(2) Fe(OH)3溶度积(或溶解度)比Mg(OH)2更小(2分)(3)11 (2分)(4)>(2分)网]
(5)羟基(1分)、羧基(1分)(若写了溴原子,不给分)
本题解析:双水解产生沉淀和气体,SFe(OH)3<SMg(OH)2 C(OH-)=10-2×0.1mol+10-4mol×1/1.1L
完全反应生成强碱弱酸盐显碱性。c(Na+) > c(A-)。
本题难度:一般
5、选择题 25℃时,将稀氨水逐滴加入稀盐酸中,当溶液的pH=7时,下列关系不正确的是( )
A.c(NH4+)=c(Cl-)
B.c(H+)=c(OH-)
C.c(NH4+)<c(Cl-)
D.c(OH-)+c(Cl-)=c(H+)+(NH4+)
参考答案:C
本题解析:
答案:C
根据电荷守恒:c(OH-)+c(Cl-)=c(H+)+(NH4+),溶液显中性,c(H+)=c(OH-),代入电荷守恒式子得,c(NH4+)=c(Cl-),综上所述,C答案不正确。
本题难度:一般