时间:2020-08-13 07:17:20
1、填空题 (10分)(I)在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气;则
(1) 烧杯中放入锌的质量大(填甲或乙);
(2) 烧杯中的酸过量(填甲或乙);
(3)反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+) (填大或小)
(II)物质的量浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和等质量的Zn反应,则下列说法正确的是:
①产生的H2质量一定相同 ②产生H2的质量一定不同
③仅有一份溶液中存在锌,则一定是盐酸 ④等倍数稀释后的反应速率A>B
⑤产生等量H2所需时间A>B ⑥产生等量H2,盐酸和醋酸一定都有剩余
(III)向体积都为1L,pH都等于2的盐酸和醋酸溶液中投入0.3g Zn,则下图中比较符合客观事实的曲线是_________________。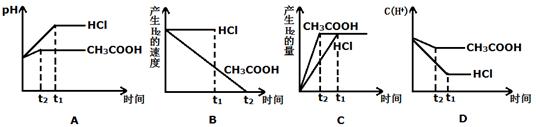
2、填空题 (10分)(1)写出下列物质的电离方程式:
①H2S:
②NaHCO3溶于水: ③NaHSO4溶于水:
(2)下出下列盐的水解方程式(离子方程式):
①NH4Cl:
②明矾净水原理(只写相应离子的水解方程式):
③泡沫灭火器(硫酸铝和碳酸氢钠)的灭火原理:
(3)写出难溶电解质的溶度积表达式。Mg(OH)2:
(4)下出下列反应方程式:
①钢铁发生吸氧腐蚀的正极反应式:
②氢氧燃料电池,H2SO4做电解质溶液,正极反应式:
③电解饱和食盐水的总反应方程式:
3、填空题 (1)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的比值关系为 。
(2)现有浓度均为0.1 mol/L的下列溶液:①氢氧化钡;②醋酸;③氢氧化钠;④盐酸,四种溶液中由水电离出的OH—浓度由大到小的顺序是(填序号) 。
(3)已知100℃ KW=10-12,若将此温度下pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积之比为 。
4、选择题 25℃的下列溶液中,碱性最强的是 ( )
A.pH = 11的溶液
B.c(OH-) =" 0.12" mol/L的溶液
C.1L中含有4 g NaOH的溶液
D.c(H+) = 1×10-10 mol/L的溶液
5、选择题 下列溶液一定呈中性的是
A.pH=7的溶液
B.c(H+)=c(OH-)=10-6 mol·L-1的溶液
C.使石蕊试液呈紫色的溶液
D.酸与碱恰好完全反应生成正盐的溶液