时间:2020-08-13 05:40:22
1、选择题 下列关于0.10 mol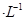 NaHSO3溶液的说法正确的是
NaHSO3溶液的说法正确的是
A.加入NaOH固体,溶液pH减小
B.温度升高,c(HSO3-)增大
C.25 C时,加水稀释后,n(H+)与n(OH-)的乘积变大
C时,加水稀释后,n(H+)与n(OH-)的乘积变大
D.NaHSO3的电离方程式为NaHSO3 = Na++H++SO32-
参考答案:C
本题解析:根据NaHSO3+NaOH=Na2SO3+H2O,加入NaOH固体,溶液PH增大,A项错误;HSO3-的电离过程和水解过程都是吸热过程,温度升高,电离过程增大,水解程度增大,c(HSO3-)减小,B项错误;在同一溶液中,n(H+)?n(OH-)=C(H+)?c(OH-)V×V=KwV×V,加水稀释,KW不变,V增大,则加水稀释后,n(H+)与n(OH-)的乘积变大,C项正确;钠盐是强电解质,电离方程式为NaHSO3 = Na++HSO3-,D项错误;选C。
考点:考查NaHSO3溶液中各种关系。
本题难度:一般
2、选择题 下列图示与对应的叙述相符的是



图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A.图Ⅰ表示t℃时冰醋酸在稀释过程中溶液导电性的变化
B.图Ⅱ表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图Ⅲ表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的大
3C(g)+D(s)的影响,乙的压强比甲的大
D.据图Ⅳ,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
参考答案:D
本题解析:A中,冰醋酸的导电性应该为0,所以A错误;B中,表示的应该为放热反应分别在有、无催化剂的情况下反应过程中的能量变化,不是吸热,所以B错误;C中错在乙的压强比甲的大,因为对可逆反应2A(g)+2B(g) 3C(g)+D(s),压强越大,反应物的百分比就越小,但是最终的百分比并不相等,故C错误;D项则是正确选项
3C(g)+D(s),压强越大,反应物的百分比就越小,但是最终的百分比并不相等,故C错误;D项则是正确选项
考点:化学平衡,电解质的导电,离子水解
点评:该题具有一定的综合性,并且还结合了图像,是高考考查的重点,具有一定的难度。
本题难度:困难
3、选择题 A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000 mL,其pH的变化如图所示,则下列判断正确的是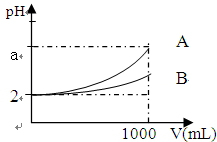
A.原酸溶液的浓度c(A)=c(B)
B.原酸溶液的浓度c(A)>c(B)
C.若a=5,则A为强酸,B为弱酸
D.若2<a<5,则A、B都是弱酸,酸性A<B
参考答案:C
本题解析:根据图像可知,在稀释过程中,B溶液的pH变化程度小于A溶液中pH的变化程度,这说明在稀释过程中B中一定存在电离平衡,可以继续电离出氢离子,所以B酸的酸性弱于A酸的酸性,A、B、D选项均是错误的,选项C正确,答案选C。
点评:该题是中等难度的试题,试题综合性强,难易适中,有利于培养学生的逻辑推理能力和抽象思维能力,特别是灵活运用基础知识解决实际问题的能力。该题关键是明确弱电解质电离平衡的特点,以及外界条件是如何影响电离平衡的。
本题难度:一般
4、填空题 将6g CH3COOH溶于水制成1L溶液,此溶液的物质的量浓度为_______,经测定溶液中含CH3COO -为1.4× 10-3 mol·L-1,此温度下醋酸的电离常数:Ka=__________,升高温度,Ka将___________(填“变大”“不变”或“变小”)。
参考答案:0.1 mol·1-1 ;1.96×10-5mol·L-1 ;变大
本题解析:
本题难度:一般
5、选择题 某化学兴趣小组在家中进行化学实验,按照图甲连接好线路发现灯泡不亮,按照图乙连接好线路发现灯泡亮,由此得出的结论正确的是(?)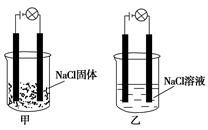
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl是弱电解质
D.NaCl在水溶液中电离出了可以自由移动的离子
参考答案:D
本题解析:电解质概念是对于化合物而言,化合物首先是纯净物,故选项B错;氯化钠为强电解质,在水中能电离出钠离子和氯离子,故选项A、C错,D正确。
本题难度:简单