时间:2019-07-04 01:26:59
1、实验题 (16分) I、实验室中常以BaSO4重量法测定BaCl2·nH2O中的Ba的含量主要步骤如下:
①?灼烧瓷坩埚至恒重,称得坩埚的质量
② 称取BaCl2·nH2O并在烧杯中溶解,加盐酸处理
③ 将一定浓度的过量硫酸滴入钡盐中得到白色沉淀
④ 静置,?
⑤ 将沉淀和滤纸置于瓷坩埚中,经酒精喷灯加热碳化后,继续在800-850℃灼烧至恒重,称重
⑥ 计算
请回答下列问题:
(1)省略第①步中“灼烧瓷坩埚至恒重”可能导致计算结果_ ______(填“偏高”、“不变”或“偏低”)。
______(填“偏高”、“不变”或“偏低”)。
(2)第④步静置后的操作是?。
(3)第⑤步灼烧温度不超过900℃,是因为_______________________。
II、某同学用氨水吸收一定量的SO2,吸收后溶液中可能含有OH-、SO32-、SO42-、 HSO3- 等阴离子中的若干种。
(4)写出氨水吸收过量SO2的反应的离子方程式:?
(5)已知亚硫酸氢盐一般可溶于水。仅限选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后溶液中是否存在SO32-、HSO3-,将实验操作、预期的实验现象和结论填在下表中。
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液。 | 若不出现浑浊,则溶液中不存在SO32-, 若出现浑浊,则溶液中可能含有SO32-。 |
| 步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中。往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入?。 | ? |
| 步骤3: | ? |
参考答案:(16分)
(1)偏低?(2分)?(2)过滤、洗涤沉淀(2分)
(3)硫酸钡会被碳还原(或“部分硫酸钡会发生分解”)(2分)
(4)NH3·H2O + SO2 = NH4+ + HSO3-?(2分)
(5)
实验操作
预期现象与结论
步骤2: 2mol/L盐酸。(1分)
若加盐酸后出现气体,则证明溶液中存在SO32-。
若无气体,则不存在SO32-。(2分)
步骤3:在试管2中加入过量2mol/L盐酸,再滴入2滴品红。
或:在试管2中加入过量lmol/L氢氧化钡溶液。(3分)
红色褪去,则存在HSO3-,红色不褪去,则不存在HSO3-。
或:出现浑浊,则存在HSO3-,不出现浑浊,则不存在HSO3-。(2分)
本题解析:略
本题难度:一般
2、简答题 硝酸铈铵[(NH4)2C他(N手3)6]广泛应用于电子、催化工业,其合成路线如他1: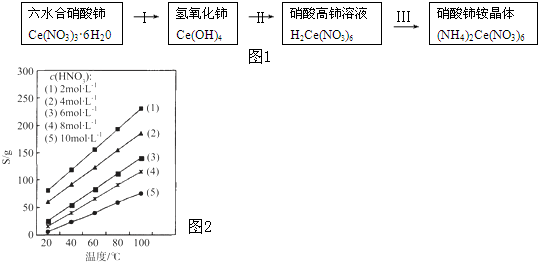
(1)已知(NH4)2C他(N手3)6受热易分解,某科研小组认为反应原理如下,请补充完整:
(NH4)2C他(N手3)6
参考答案:(3)由质量守恒定律可知反应的方程式应为(NH着)人Ce(NO3)6△.CeO人?8OH+8NO↑,生成的另一种物质为NO,NO不稳定,易被氧化生成红棕色的NO人,
故答案为:NO;产生红棕色气体;
(人)Ge元素化合价由+3价升高到+着价,被氧化,Ce(NO3)3?6H人O为还原剂,H人O人为氧化剂,O元素化合价由-3价降低到-人价,由化合价升降总数相等可知氧化剂和还原剂的物质的量之比应为3:人,
故答案为:3:人;
(3)溶度积为溶液离子浓度的幂次方的乘积,Ce(OH)着的溶度积表达式为c(Ce着+)?[c(OH-)]着,残留在溶液1的c(Ce着+)小于3×30-5mol?L-3,
则c(OH-)>Kspc(Ce着+)=着3×30-人f3×30-5
本题解析:
本题难度:一般
3、选择题 下列有关实验操作的叙述正确的是(?)
A.用CCl4萃取碘水中的I2时,有机层从分液漏斗的下端放出
B.除去铜器表面的铜绿[Cu2(OH)2CO3]:用盐酸浸泡,再用清水冲洗
C.除去CO2气体中的少量HCl:通入Na2CO3溶液洗气
D.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液
参考答案:AB
本题解析:略
本题难度:一般
4、简答题 【化学与技术】
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。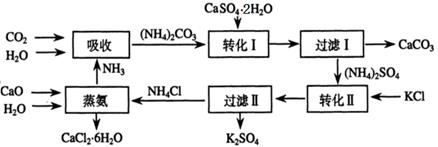
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要?等原料。
(2)石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式为?。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有?(填化学式)等物质,该固体可用作生产水泥的原料。
(4)检验过滤Ⅰ所得滤液中含有CO32-的方法是?。
(5)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是?。
a.熔点较低(29℃熔化)? b.能导电? c.能制冷? d.无毒
(6)上述工艺流程中体现绿色化学理念的是?。
参考答案:(1)CaCO3、NH3、H2O
(2)CaSO4+CO32-=CaCO3+SO42-?
(3)CaSO4
(4)滤液中滴加盐酸产生气泡?
(5)ad
(6)碳酸钙用于制取水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中)
本题解析:(1)根据流程可知,需要生石灰、二氧化碳、氨气、水、碳酸钙高温分解即生成氧化钙和二氧化碳,所以本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要CaCO3、NH3、H2O等原料。
(2)碳酸钙的溶解度小于硫酸钙,因此根据沉淀转化原理知,石膏悬浊液中加入碳酸铵溶液后发生的离子方程式为CaSO4+CO32-=CaCO3+SO42-。
(3)硫酸钙微溶于水,所以过滤I操作所得固体中,除CaCO3外还含有CaSO4等物质。
(4)由于碳酸盐能和盐酸反应产生二氧化碳气体,所以检验过滤I所得滤液中含有CO32-的方法是滤液中滴加盐酸产生的气泡。
(5)储热材料与物质的导电性以及能否制冷无关系,而与自身的熔点高低和有无毒性无关系,所以选ad。
(6)根据流程图知,工艺流程中体现绿色化学理念的是反应中产生的碳酸钙用于制取水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等。
本题难度:一般
5、选择题
①用蒸馏的方法可将海水淡化
②将混合气体通过盛有品红溶液的洗气瓶,可除去CO2中的SO2
③向溶液中滴入盐酸酸化的氯化钡溶液可检验溶液中是否含有SO42—
④向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,充分反应后过滤,可除去Ca(OH)2
A.①②
B.①④
C.②③
D.③④
参考答案:B
本题解析:海水中含有较多的盐份,蒸馏海水由于盐的沸点很高不会蒸出,故①用蒸馏的方法可将海水淡化;二氧化硫与品红溶液反应是可逆的,除不干净,另外二氧化碳也会溶于水,所以要除去二氧化碳中的二氧化硫,应将其通入饱和碳酸氢钠溶液之中,所以②不对;③向溶液中滴入盐酸酸化的氯化钡溶液不能检验溶液中是否含有SO42-因为不能排除银离子的干扰;由于氢氧化镁比氢氧化钙难溶,故向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,镁离子会结合氢氧根离子生成氢氧化镁的沉淀,使氢氧化钙不断溶解而除去。故选B,其实这题也最好是用淘汰法,很快就可解出。
本题难度:一般