时间:2019-07-04 01:26:59
1、填空题 “套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验。因其具有许多优点,近年被广泛开发并应用于化学实验中。请观察下图装置(小试管内塞有沾有无水硫酸铜粉末的棉花球)。请回答下列问题: 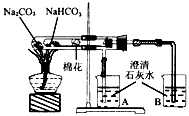
(1)从点燃酒精灯开始,试管及烧杯A、B中能观察到的现象有 __________________________________。
(2)实验结束时,在操作上需要特别注意的问题是_______________________________________________。
(3)通过该实验可以得出的结论是________________________________。
2、简答题 电石浆是氯碱工业中的一种废弃物,其大致组成如表所示:
| 成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其他不溶于酸的物质 质量分数(%) 65~66 3.5~5.0 1.5~3.5 0.2~0.8 0.2~1.1 1.0~1.8 23-26 |
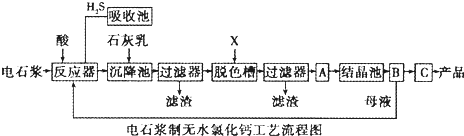
3、简答题 海洋植物如海带、海藻中含有丰富的碘元素,碘元素以离子的形式存在.实验中从海藻提取碘的流程如图所示.
(1)指出提取碘的过程中有关的实验操作名称①______;写出过程②中有关反应的化学方程式______.
(2)提取碘的过程中可提供选择的有机试剂为______
A.酒精、四氯化碳B四氯化碳、苯C.汽油、醋酸D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是______.
4、填空题 单质碘有非常重要的用途,它的制备一般有两种方法:
方法一:海带、海藻燃烧后所得的灰份中含I-,从中获得I-,由I-制备I2.
某研究性学习小组为了从海带中提取碘,设计并进行了以下实验:
请回答:
(1)步骤①中灼烧海带用到的实验仪器有坩埚钳、铁三脚架、泥三角、酒精灯和______(填字母).
A.试管B.瓷坩埚C.烧杯D.量筒
(2)步骤③的实验操作名称是______;
(3)步骤④中氧化剂最好选用______(填字母)
A.浓硫酸B.新制氯水
C.酸性KMnO4溶液D.3%H2O2溶液和稀H2SO4混合液
其反应的离子方程式是______.
(4)步骤⑤中,学生选择用苯来提取碘,还可以用下列______(填字母)来提取碘.
A.乙酸B.四氯化碳C.酒精D.己烷
(5)步骤⑤中,为了检验提取碘后的水溶液中是否还含有单质碘,取少量上述溶液于试管中,滴加______,如果看到______,则证明溶液中还含有碘.
(6)步骤⑤中为了得到含碘苯溶液,某学生设计了以下操作步骤:
a.将含碘的水溶液置于分液漏斗中
b.加入适量的苯
c.分离出下层液体
d.分离出上层液体,即得到含碘苯溶液
以上设计中有遗漏的操作.应该在步骤______(填字母)后,增加操作:______.
方法二:从智利硝石中获得碘酸钠(NaIO3),再用NaHSO3把碘酸钠还原为I2.实际生产中分两步进行:
第一步:先用适量的NaHSO3将碘酸钠还原成I-,反应的离子方程式为:
IO3-+3HSO3-=I-+3SO42-+3H+;
第二步:向所得的酸性I-溶液中加入适量的碘酸钠(NaIO3)溶液便有碘析出,反应的离子方程式为______.
5、实验题
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
⑴加热前通入空气的目的是____? ___,操作方法为______________________________________________。
⑵装置A、C、D中盛放的试剂分别为A_______,C______,D______。
⑶若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将__________(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中测定结果中NaHCO3的含量将___________;若撤去E装置,则测得Na2CO3·10H2O的含量__________。
⑷若样品质量为w g,反应后C、D增加的质量分别为m1 g、m2 g,由此可知混合物中
NaHCO3质量分数为_____________________(用含w、m1、m2的代数式表示)