时间:2019-07-04 00:40:11
1、选择题 类推的思维方法在化学学习与研究中常会产生错误的结论。因此,类推出的结论最终要经过实践的检验才能决定其正确与否。以下几种类推结论中,正确的是
A.Fe3O4可以写成FeO·Fe2O3,Pb3O4也可以写成PbO·Pb2O3
B.不能用电解AICl3溶液来制取金属铝,也不能用电解MgCl2溶液来制取金属镁
C.Fe和S直接化合不能得到Fe2S3,Al和S直接化合也不能得到Al2S3
D.FeS可以和稀硫酸反应制取硫化氢气体,CuS也可以和稀硫酸反应制取硫化氢气体
2、选择题 下列过程中,没有明显实验现象的是( )
A.向Fe(NO3)2溶液中滴加稀硫酸
B.将HCl通入NaAlO2溶液中
C.加热溶有SO2的品红溶液
D.向碳酸氢钠溶液中滴加氢氧化钠溶液
3、选择题 下表各物质中,A、B、C、D、E均含有同一种短周期元素,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。则各物质之间通过一步反应就能实现表中所示转化的是( )
| 物质编号 | 物质转化关系 | A | D | E |
| ① | 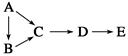 | Si | SiO2 | H2SiO3 |
| ② | S | SO3 | H2SO4 | |
| ③ | Na | Na2O2 | NaOH | |
| ④ | N2 | NO2 | HNO3 |
4、选择题 简单原子的原子结构可用右图形象地表示:其中●表示质子或电子,o表示中子,则下列有关①②③的叙述正确的是( )
A.①②③互为同位素
B.①②③为三种不同元素的原子
C.①②③是三种化学性质完全不同的粒子
D.①②③具有相同的质量数
5、选择题 X、Y、Z三种元素原子的核电荷数在11—17之间。它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4?。则下列判断不正确的是
[? ]
A.最高正价:X>Y>Z?
B.酸性:H3ZO4>H2YO4>HXO4?
C.稳定性:HX>HY>HZ?
D.非金属性:X>Y>Z