时间:2019-07-04 00:40:11
1、选择题 X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:
①X、Y、W分别位于不同周期;②在元素周期表中,Z与Y、W均相邻;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法正确的是
[? ]
A.X元素既能形成离子化合物,又能形成共价化合物
B.原子半径大小为: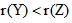
C.X与其余三种元素之间形成的核外电子总数为10的微粒只有4种
D.H2Z的熔点比H2W高,是因为H2Z分子内存在氢键
2、选择题 据新华社报道,我国科学家首次合成了镅的一种新同位素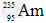 它和
它和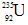 比较,下列叙述中不正确的是?
比较,下列叙述中不正确的是?
[? ]
A.具有非常接近的相对原子质量 ?
B.原子核中的中子数和电子数都不相同
C.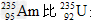 比?少3个中子? ?
比?少3个中子? ?
D.它们互为同位素?
3、选择题 X、Y、Z、W均为短周期元素,在周期表中位置如图所示。Y原子的最外层电子数是电子层数的3倍。下列说法中不正确的是
[? ]
A.YnZ的气态氢化物,前者更稳定
B.Z、W的最高价氧化物对应水化物的酸性,前者强
C.X、W的气态氢化物相互反应,生成物中既含离子键又含共价键
D.Y、W的单质,均可通过电解的方法获得
4、推断题 A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1)?X在周期表中的位置是_____________________________。
(2)?化合物Y2X2的电子式为________;它含有的化学键类型有_________(填序号)。
A.离子键?B.极性共价键?C.非极性共价键?D.氢键
(3)?A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_____________________________________。
(4)?A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为_____________________________________。
(5)?写出化合物Y2X2与水反应的离子方程式____________________________。
(6)?B的最高价氧化物的结构式为____________________________________。
5、选择题 元素周期律与原子结构理论出现的年号
A.前者大
B.后者大
C.相等
D.不能确定