时间:2019-07-03 23:05:49
1、简答题 (4分)简答题
(1)盐碱地因含较多的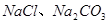 ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有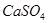 ,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释
,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释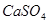 的作用?。
的作用?。
(2)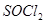 是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将
是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将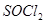 与
与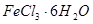 混合并加热,可得到无水
混合并加热,可得到无水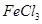 ,得到无水
,得到无水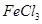 的化学方程式为?。
的化学方程式为?。
参考答案:(1)石膏电离出的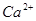 与
与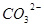 结合生成更难溶的
结合生成更难溶的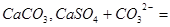
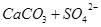 ?(或
?(或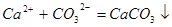 ),
),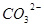 浓度降低,使得
浓度降低,使得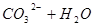
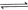
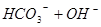 平衡向左移动,
平衡向左移动,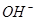 浓度降低,碱性减弱。(离子方程式书写正确,文字表述合理即可得分)(2分)
浓度降低,碱性减弱。(离子方程式书写正确,文字表述合理即可得分)(2分)
(2)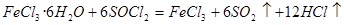 (2分)
(2分)
(化学方程式中化学式书写正确、配平正确即可得分,没有标明“↑”“↓”不扣分,下同)
本题解析:(1)考查沉淀溶解平衡的应用。硫酸钙能电离出钙离子,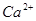 与
与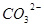 结合生成更难溶的
结合生成更难溶的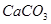 ,方程式为
,方程式为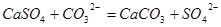 ,
,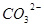 浓度降低,使得平衡
浓度降低,使得平衡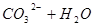
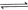
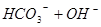 向逆反应方向移动,导致
向逆反应方向移动,导致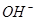 浓度降低,碱性减弱。
浓度降低,碱性减弱。
(2)氯化铁水解生成氢氧化铁和氯化氢,水解吸热,加热促进水解,氯化氢挥发,进一步促进水解,所以最终得不到氯化铁晶体。要得到氯化铁晶体,需要在氯化氢的气流中加热。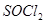 和水剧烈反应得到二氧化硫和氯化氢,抑制铁离子水解,方程式为
和水剧烈反应得到二氧化硫和氯化氢,抑制铁离子水解,方程式为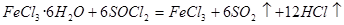 。
。
本题难度:一般
2、填空题 (Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
 H++B2-
H++B2-参考答案:(1)a=7时,HA是强酸;a>7时,HA是弱酸
(2)C
(3)c(Na+)>c(A-)>c(OH-)>c(H+)
(4)10-4-10-10
(5)A、C
本题解析:(1)一元酸HA与NaOH等物质的量反应,酸性强弱取决于完全中和后盐的pH,a=7为强酸,a>7为弱酸;
(2)根据电荷守恒,有c(Na+)+c(H+)=c(A-)+c(OH-),因c(H+)=c(OH-),所以c(Na+)=c(A-);
(3)丙为等浓度的HA与NaA的混合溶液,由pH>7知A-水解程度大于HA的电离,离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+);
(4)据电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),推导c(Na+)-c(A-)=c(OH-)-c(H+)=10-4-10-10;
(5)注意题干中的电离方程式,判断A项为B元素的物料守恒,C项为溶液中的质子守恒。
本题难度:困难
3、选择题 化学中常借助图象来表示某种变化过程,下列关于4个图象的说法正确的是( )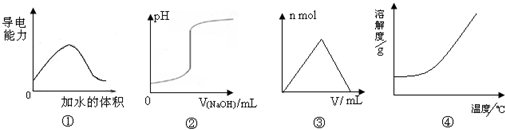
A.图①可表示t℃时,冰醋酸稀释过程中溶液导电性的变化
B.图②可表示向一定量盐酸中滴加一定浓度氢氧化钠溶液时,溶液pH的变化
C.图③可表示向一定量明矾溶液中滴加一定浓度氢氧化钡溶液时,产生沉淀的物质的量的变化
D.图④可表示所有的固体物质溶解度随温度的变化
参考答案:A.溶液导电性强弱取决于溶液中离子浓度的大小,纯净的醋酸不存在离子不导电,图象起点错误;故A错误;
B.向一定量的盐酸溶液中滴加一定浓度的氢氧化钠,溶液pH逐渐增大;故B正确;
C.向一定量的明矾溶液中滴加一定浓度氢氧化钡溶液时,产生沉淀逐渐增大,当Ba2+完全沉淀之后,生成的氢氧化铝继续与OH-离子反应,沉淀部分溶解;故C错误;
D.氯化钠随温度的增大变化不大.氢氧化钙溶解度随温度升高减小;故D错误;
故选B.
本题解析:
本题难度:一般
4、选择题 常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11的氨水;
④pH=11的NaOH溶液。下列说法正确的是
[? ]
A.①与②中c(H+)相同
B.①与④混合,溶液中c(CH3COO-)=c(Na+)
C.②和③混合,所得混合溶液的pH大于7
D.③与④分别用等浓度的盐酸中和,消耗盐酸的体积相等
参考答案:AC
本题解析:
本题难度:一般
5、选择题 已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+?要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是
CH3COO-+H+?要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是
[? ]
A.加少量CH3COONH4固体?
B.降低温度?
C.加少量NaCl固体?
D.升高温度
参考答案:D
本题解析:
本题难度:一般