时间:2019-07-03 23:05:49
1、填空题 为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:0.010 mol·L-1氨水、0.1 mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?________(填“是”或“否”)并说明理由______________
(2)乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测出其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测出其pH为b,若要确认NH3·H2O是弱电解质,则a、b值应满足什么关系?________(用“等式”或“不等式”表示)。
(3)丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞溶液,显粉红色,再加入NH4Cl晶体少量,颜色变浅。你认为这一方法能否证明NH3·H2O是弱电解质?并说明原因:______________________________________________________________________。
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质:__________________________________________________________________。
2、选择题 如图是一水溶液在pH从0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的各组分分数,下列叙述正确的是( )
A.pH=2时,H2CO3、HCO3-、CO32-共存
B.在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在
D.若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上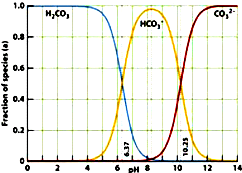
3、选择题 常温条件下列溶液中离子浓度的等量关系正确的是( )
A.0.1mol/L氨水中:c(NH4+)+c(H+)=c(OH-)
B.0.1mol/L的NH4Cl溶液中:c(NH4+)=c(Cl-)
C.同为0.1mol/L的硫酸和氨水等体积混合后:c(NH4+)+c(2NH3?H2O)=2c(SO42-)
D.pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-)=c(H+)
4、选择题 PH=2的两种一元酸x和y,体积均为100ml,稀释过程中PH与溶液体积的关系如图所示,分别滴加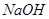 溶液(c=0.1
溶液(c=0.1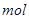 /L)至PH=7,消耗
/L)至PH=7,消耗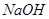 溶液的体积为Vx,Vy,则
溶液的体积为Vx,Vy,则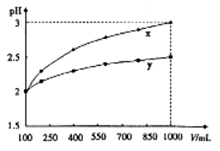
A.x为弱酸Vx<Vy
B.x为强酸Vx>Vy
C.y为强酸Vx>Vy
D.y为弱酸Vx<Vy
5、选择题 pH相同的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌粒全部溶解且放出气体一样多,为此下列说法正确的是
A.反应开始时的速率:甲<乙
B.反应开始时,酸的物质的量浓度:甲<乙
C.反应所需时间:甲<乙
D.反应后溶液的pH:甲<乙