时间:2019-06-28 21:30:24
1、填空题 锶(Sr)为第五周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高?的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如下图。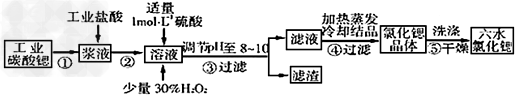
?请回答: ?
(1)氯化锶溶液显________(填“酸性"、“碱性”或“中性”); ?
(2)写出步骤②在浆液中加入盐酸时发生反应的离子方程式_________________________?
(3)步骤③中调节溶液pH至8~10,宜选用的试剂为_______________。
A.稀硫酸?B.氢氧化锶粉末?C.氢氧化钠?D.氧化锶粉末 ?
所得滤渣的主要成分是______________(填化学式)。 ?
(4)步骤⑤中,洗涤氯化锶晶体最好选用___________。 ?
A.水?B.稀硫酸?C.氢氧化钠溶液?D.氯化锶饱和溶液 ?
工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是___________________。?
(5)若滤液中Ba2+?浓度为1×10-5mol/L,依据下表数据可以推算滤液中Sr2+物质的量浓度为___________________。 
2、填空题 硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下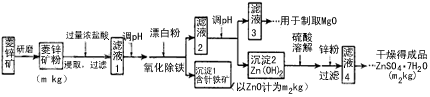
(1) 将菱锌矿研磨成粉的目的是_______________________。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
____Fe(OH)2+_______+_______→______Fe(OH)3+_______Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节滤液2的pH时,理论上可选用的最大区间为______。 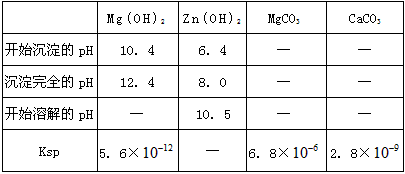
(5)工业上从滤液3制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)滤液4之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
3、填空题 亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程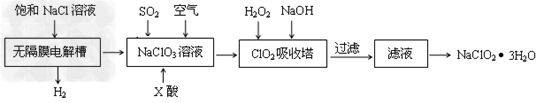
已知:
①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出。
②ClO2气体只能保持在稀释状态下以防止爆炸性分解,且需现合成现用。
③ClO2气体在中性和碱性溶液中不能稳定存在。 ?
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式:____________________。
(2)反应生成ClO2气体需要X酸酸化的原因为:________X酸为_________。
(3)吸收塔内的温度不能过高的原因为:____________________________
(4)吸收塔内ClO2随着还原剂的不同和溶液酸碱性的变化可被还原为ClO2-或Cl-。ClO2被S2-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。请写出pH≤2时ClO2与S2-反应的离子方程式: 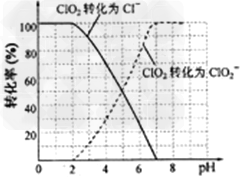
(5)第二步向NaClO3溶液中通SO2的同时通入空气的原因为:____________________。
(6)从滤液中得到NaClO2·3H2O粗晶体的操作步骤为_______?、_______、________。
4、填空题 草酸亚铁用作分析试剂及显影剂等,其制备流程如下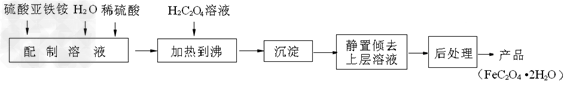
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加少量稀硫酸,目的是______________?。
(2)将制得的产品在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。 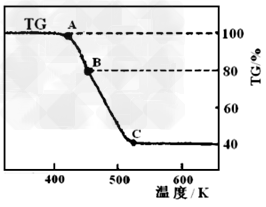
① A→B发生反应的化学方程式为_______________。 C处时残留物的化学式为__________。
②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:______________?。
③?现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g)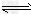 Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?________________
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?________________
5、填空题 草酸亚铁用作分析试剂及显影剂等,其制备流程如下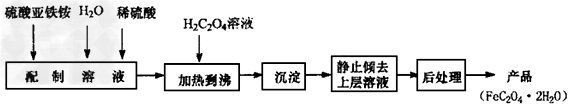
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加少量稀硫酸,目的是_________________。
(2)将制得的产品在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。 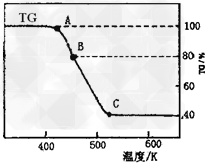
①则C处时残留物的化学式为______________。
②有研究学者在实验过程中用气相色谱还检出H2,最终产?物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:___________________。
③现取在真空中146℃脱水后的FeC2O4 1.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g) Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?_________________。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?_________________。
(3)金属镁在国民生产中有重要作用,常以MgCl2为原料获取,温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。结合下图请回答下列问题: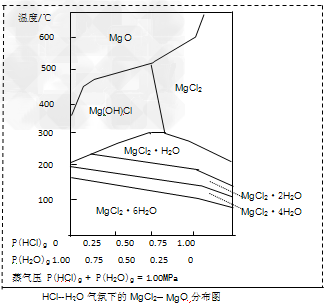
①写出P(HCl)g?=?0.25MPa,温度从300℃升高到550℃时反应的化学方程式_______________________;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是________________;若要得到无水MgCl2须采取的措施是__________________。