时间:2019-06-28 21:30:24
1、选择题 天然气(CH4)、液化石油气(C3H8)燃烧的化学方程式分别为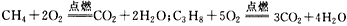 现有一套以天然气为燃料的灶具,欲改为燃烧石油气,应采取的措施是
现有一套以天然气为燃料的灶具,欲改为燃烧石油气,应采取的措施是
[? ]
A.减小空气进入量,增大石油气进入量
B.增大空气进入量,减小石油气进入量
C.减小空气进入量,减小石油气进入量
D.增大空气进入量,增大石油气进入量
参考答案:B
本题解析:
本题难度:简单
2、填空题 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。?
Ⅰ.用乙烯作为还原剂将氮的氧化物还原为N2是燃煤烟气的一种脱硝(除NOx)技术。其脱硝机理如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如下图2所示。 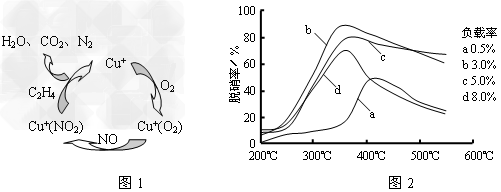
①写出该脱硝过程中乙烯和NO2反应的化学方程式____________________________。
②为达到最佳脱硝效果,应采取的条件是_______________。
Ⅱ.有学者设想以下图所示装置用电化学原理将燃煤烟气中的CO2、SO2转化为重要化工原料。 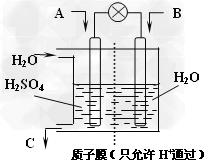
(1)若A为CO2,B为H2,C为CH3OH,则正极电极反应式为_______________。
(2)若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟从C处获得100mL10mol/L
H2SO4,则A处通入烟气(SO2的体积分数为1%)的速率为______?L/min(标准状况)。
Ⅲ.粗CuO是将工业废铜、废电线及废铜合金高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备CuSO4 5H2O的主要步骤如下图所示:
5H2O的主要步骤如下图所示: 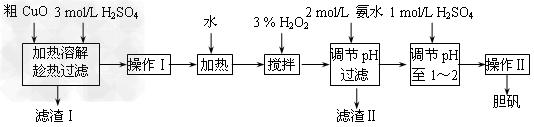
Fe3+、Fe2+、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表
(1)加入3?%?H2O2之前需将热溶液冷却,其目的是____________,H2O2的作用是____________________________。
(2)加入2?mol/L氨水后,溶液的pH应在_____________范围内。
(3)经操作Ⅰ得到粗胆矾,经操作Ⅱ得到精制胆矾。两步操作相同,都包括______?、过滤、洗涤、干燥等步骤。
参考答案:Ⅰ.①2C2H4+6NO2=4CO2+3N2+4H2O?[或2CH=CH2+6NO2→4CO2+3N2+4H2O]
②350℃(或340℃~360℃)?、负载率3%?
Ⅱ.(1)CO2+6H++6e-=CH3OH+H2O;(2)2240?
Ⅲ.(1)防止H2O2分解;将Fe2+氧化为Fe3+,使之在Cu2+之前沉淀;(2)3.2~4.7;?(3)蒸发浓缩、冷却结晶
本题解析:
本题难度:困难
3、填空题 某铜矿石含氧化铜、氧化亚铜、三氧化二铁和大量脉石(SiO2),现采用酸浸法从矿石中提取铜,其流程图如下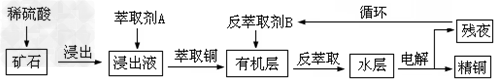
已知:?
①当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;
②反萃取后的水层是硫酸铜溶液,Cu2+浓度约为50g/L。
回答下列问题:
(1)矿石用稀硫酸浸出过程中氧化亚铜发生的反应为:Cu2O+2H+==Cu2++Cu+H2O;请写出该过程中发生的另一个氧化还原反应的离子方程式:______________________。
(2)写出用惰性电极电解水层的电解总反应方程式:_________________________。
(3)循环中反萃取剂B的主要成分是___________________。
(4)某铜矿石样品中,若仅含氧化亚铜、三氧化二铁和脉石三种物质。取该矿石样品200.0g,用100mL1.0mol/LH2SO4溶液浸取后,还需加入10mL?1.0mol/L?Fe2(SO4)3溶液才能使铜全部浸出,浸取液经充分电解后可得到?6.4gCu。求铜矿石样品中氧化亚铜和氧化铁的质量分数?
参考答案:(1)Cu+2Fe3+==2Fe2++?Cu2+
(2)2CuSO4?+?2H2O O2↑+?2Cu?+?2H2SO4
O2↑+?2Cu?+?2H2SO4
(3)H2SO4
(4)Cu2O:3.6%?;Fe2O3:3.2%
本题解析:
本题难度:一般
4、填空题 无铁硫酸铝是制造高档纸张和高级织物的重要原材料,制取无铁硫酸铝的工艺流程如下图所示。铝土矿酸溶后得到含铁(Fe2+和Fe3+)的硫酸铝溶液,再经过后续加工,最终得到成品无铁硫酸铝(溶液中各种金属离子开始沉淀和沉淀完全时的pH见表)。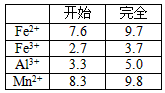
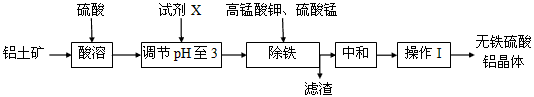
(1)试剂X可以用下列试剂中的__________(填编号)
a.铝土矿粉 b.氢氧化钠 c.氧化钙
(2)生产中控制pH为3而不大于3的原因是_________________;
(3)除铁时,必须先加入高锰酸钾溶液,目的是_____________________;高锰酸钾溶液和硫酸锰溶液反应生成活性二氧化锰,写出反应的化学方程式____________________;
(4)滤渣的含铁成分是__________;
(5)活性二氧化锰能和Fe(OH)3发生吸附共沉作用,用化学平衡理论解释活性二氧化锰的作用______________________。
参考答案:(1)a
(2)pH超过3.3将导致Al3+沉淀,降低成品产量(意思合理即可)
(3)把Fe2+转化为Fe3+;2KMnO4+3MnSO4+2H2O==5MnO2↓+2H2SO4+K2SO4
(4)Fe(OH)3
(6)吸附Fe(OH)3,促使Fe3+水解而充分沉淀(或促使水解平衡正向移动)
本题解析:
本题难度:一般
5、填空题 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: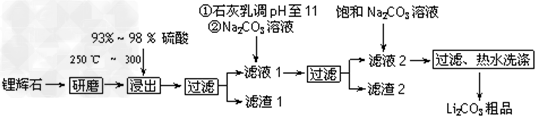
已知:①?Li2O·Al2O3·4SiO2?+H2SO4(浓)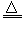 Li2SO4+Al2O3·4SiO2·H2O↓ ?
Li2SO4+Al2O3·4SiO2·H2O↓ ?
②?某些物质的溶解度(S)如下表所示。 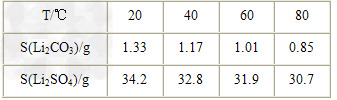
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是__________________________。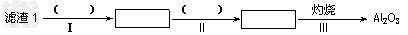
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)_______________________。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是__________________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①?a中,阳极的电极反应式是___________________。
②为什么要用离子选择透过膜隔开________________(任写一点)
③?b中,生成Li2CO3反应的化学方程式是__________________。
参考答案:(1)Al3++3NH3·H2O = Al(OH)3↓+3NH4+
(2)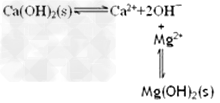 ?
?
(3)Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(4)① 2Cl-―2e- = Cl2↑;②防止氯气与氢氧化锂反应,使产品不纯,防止氯气与氢气发生反应,引起爆炸;③?2LiOH+NH4HCO3 = Li2CO3+NH3+2H2O
本题解析:
本题难度:一般