时间:2019-06-28 21:30:24
1、选择题 实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂.发生铝热反应之后,所得固体中含金属单质为18g,则该氧化物粉末可能是( )
A.Fe3O4和FeO
B.MnO2和V2O5
C.Cr2O3和V2O5
D.Fe2O3和MnO2
参考答案:AD
本题解析:
本题难度:简单
2、填空题 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示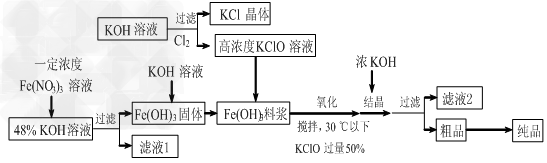
(1)上述氧化过程中,发生反应的离子方程式是:________________,控制反应温度30℃以下的原因是:___________________。
(2)结晶过程中加入浓KOH溶液的作用是:___________________。
(3)根据图1、图2回答:为了获取更多的高铁酸钾,铁盐的质量分数应控制在_____附近、反应时间应控制在________。 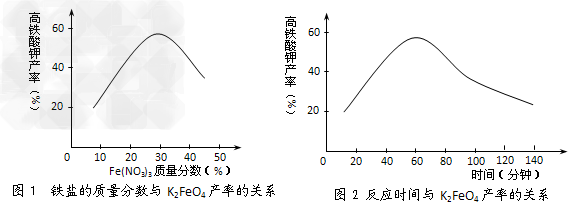
参考答案:(1)2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O;防止生成的K2FeO4发生分解
(2)增大K+,促进K2FeO4晶体析出?
(3)30%;60min
本题解析:
本题难度:一般
3、填空题 2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的,回收利用锂资源成为重要课题。某研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如下:
已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。 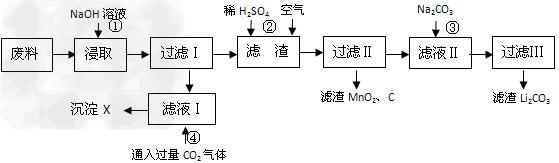
(1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是_______________。
(2)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求__________________________。
(3)写出反应④生成沉淀X的离子方程式:________________________?。
(4)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的化学反应方程式:_____________________________。
(5)生成Li2CO3的化学反应方程式为___________________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应______________。
参考答案:(1)增大接触面积,加快反应速率
(2)隔绝空气和水分
(3)CO2+AlO2–+2H2O=Al(OH)3↓+HCO3–
(4)4LiMn2O4+2H2SO4+O2=8MnO2+2?Li2SO4+2H2O
(5)Li2SO4+Na2CO3=Na2SO4+Li2CO3↓;趁热过滤
本题解析:
本题难度:一般
4、填空题 CoCl2·6H2O是一种饲料营养强化剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图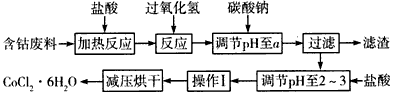
已知:
①钴与盐酸反应的化学方程式为Co+2HCl=CoCl2+H2↑。
②CoCl2·6H2O的熔点为86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表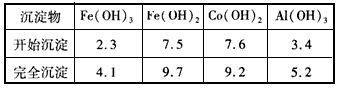
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点是
___________________
(2)加入碳酸钠调节pH至a,a的范围是_______________。
(3)操作I包含3个基本实验操作,它们是____________和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是______________________。
(5)为测定产晶中CoCl2·6H2O的含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是__________________。
(6)在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是_____________。
参考答案:(1)减少有毒气体的排放,防止大气污染,防止产品中混有硝酸盐
(2)5.2~7.6
(3)蒸发浓缩、冷却结晶
(4)降低烘干温度,防止产品分解
(5)样品中含有NaCl杂质,烘干时失去了部分结晶水
(6)将产品溶于乙醚,过滤后,再蒸馏
本题解析:
本题难度:一般
5、填空题 【三选一—选修化学与技术】
晶体硅可用作制芯片和太阳能电池等。下列流程图是工业上制取纯硅的一种方法。 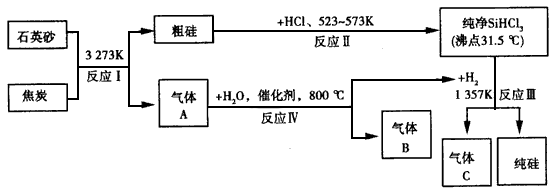
请回答下列问题(各元素用相应的元素符号表示)。
(1)在上述生产过程中,属于置换反应的有__(填反应的代号“I~Ⅳ”)。
(2)A、B、C三种气体在上述生产过程中可循环利用的是___;在“节能减排”中作为减排目标的一种气体是___。
(3)化合物甲的用途很广,有些已应用于高、精、尖科技领域。通常可作建筑工业和造纸工业上的黏合剂。将石英砂和纯碱按一定比例混合加热至1373~1 623 K反应生成化合物甲,其化学方程式为___。
(4)利用反应Ⅲ能制得纯硅的原因是___。
(5)已知反应Ⅳ中产物的总能量比反应物的总能量低,则在密闭容器内反应Ⅳ达到平衡,改变下列 条件,气体B的物质的量增大的是___。
a.缩小容器的容积
b.降低反应体系的温度
c.加入少量NaOH固体(生成物在此温度下不分解)
d.加入少量催化性能更好的催化剂
(6)金属镍(Ni)与气体A能形成常温下为液态的Ni(A)4、利用Ni(A)4的生成与分解可以制得纯度很高的纳米镍,写出Ni( A)4在423K时分解的化学方程式___。
参考答案:(1)I、Ⅱ、Ⅲ
(2)CO、HCl;CO2
(3)SiO2+Na2CO3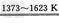 Na2SiO3+CO2↑
Na2SiO3+CO2↑
(4)反应体系中只有Si是固体,其他物质在1357?K下均为气体且在Si 中不溶解
(5)b
(6)Ni(CO)4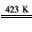 Ni+4CO↑
Ni+4CO↑
本题解析:
本题难度:一般