时间:2019-06-28 21:30:04
1、选择题 已知3克乙烷在常温下完全燃烧放出的热量是155.98kJ,则下列乙烷燃烧热的热化学方程式书写正确的是( )
A.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H ="-2119.6" kJ/mol
B.C2H6(g)+5/2O2(g)=2CO2(g)+3H2O(g)△H ="-1559.8kJ/mol"
C.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(g)△H ="-1559.8" kJ/mol
D.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l)△H ="-1559.8" kJ/mol
参考答案:D
本题解析:由题目所给信息可折算出1mol乙烷完全燃烧时所放出的热量为1559.8 kJ,再结合燃烧热的概念(1mol可燃物完全燃烧生成稳定的氧化物所放出的热量),则答案为D
本题难度:一般
2、选择题 在下列各说法中,正确的是(?)
A.对于2SO2(g)+O2(g)  2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
B.热化学方程式中的化学计量数不能用分数表示
C.Zn(s)+H2SO4(aq) =ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能
D.ΔH的大小与热化学方程式的化学计量数无关
参考答案:C
本题解析:A选项为可逆反应,当冲入1molSO2和足量氧气,则反应平衡向正反应方向移动,放出热量大于Q/2 kJ。B选项,错误。热反应方程式化学计量数可以用分数表示。C选项,正确。凡是氧化还原反应,即有电子转移,理论上都可以作为原电池。D选项错误。焓变的大小与反应物质的物质的量有关,焓变与与反应的化学计量数一一对应的。
本题难度:简单
3、填空题 (12分)中和热的测定是高中重要的定量实验。取0.55 mol/L的NaOH溶液50 mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题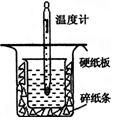
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是_________ _,除此之外,装置中的一个明显错误是 。
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热数值会_________,(填“偏大”、“偏小”或“不变”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求中和热 (填“相等”或“不相等”),简述理由: 。
(4)某实验小组用盐酸和氢氧化钠溶液做了三次实验,每次取溶液各50 mL,并记录下原始数据:
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
| 3 | 25.1 | 25.1 | 25.1 | 27.1 | 2.0 |
参考答案:
(1)环形玻璃搅拌棒;小烧杯口未用硬纸板盖住(或大烧杯内碎纸条塞少了,未将小烧杯垫的足够高)
(2)偏小
(3)相等 因为计算中和热要折算成生成1 mol H2O所放出的热量(与所用酸、碱的用量无关)
(4)HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-56.85 KJ/mol.
本题解析:测定中和热应尽量减少热量的损失,且使酸与碱快速充分反应,(1)从装置图可以看出缺少环形玻璃搅拌棒;小烧杯口未用硬纸板盖住(或大烧杯内碎纸条塞少了,未将小烧杯垫的足够高)会造成热量的损失。(2)醋酸是弱酸,电离过程会吸收热量,则测得的中和热数值会偏小;(3)中和热是指中和生成1 mol H2O所放出的热量(与所用酸、碱的用量无关);(4)分析三组数据,舍去第3组数据,取前两组数据的平均值进行计算,反应生成水的物质的量为0.050L×0.5m ol/L=0.025mol,放出的热量为Q=3.4℃×100g×4.18×10-3 kJ/(g·℃)=1.4212KJ,则中和热△H=-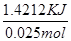 =-56.85 KJ/mol.
=-56.85 KJ/mol.
考点:中和热的测定
本题难度:一般
4、选择题 下列说法正确的是( ? )
A.第二周期元素的第一电离能随原子序数递增依次增大
B.卤族元素中氟的电负性最大
C.CO2、SO2都是直线形的非极性分子
D.CH2===CH2分子中共有四个σ键和一个π键
参考答案:B
本题解析:A不正确,其中Be和N属于全充满或半充满,第一电离能分别大于B和O的。氟是最强的非金属,电负性最大,B正确。SO2是v形的极性分子,C不正确。双键是由1个σ键和一个π键构成,所以乙烯中共有5个σ键和一个π键,D不正确。答案选B。
本题难度:一般
5、选择题 能用离子方程式H++OH-=H2O表示的反应是
A.稀醋酸和氢氧化钾反应
B.硫酸氢钠和烧碱溶液反应
C.稀盐酸和氢氧化铜反应
D.稀硫酸和氢氧化钡溶液反应
参考答案:B
本题解析:分析:强酸与强碱反应生成可溶性盐和水的反应可用离子方程式H++OH-=H2O表示,以此来解答.
解答:A.稀醋酸和氢氧化钾反应的离子反应为HAc+OH-=H2O+Ac-,故A错误;
B.硫酸氢钠和烧碱溶液反应的离子方程式为H++OH-=H2O,故B正确;
C.稀盐酸和氢氧化铜反应的离子反应为2H++Cu(OH)2=Cu2++2H2O,故C错误;
D.稀硫酸和氢氧化钡溶液反应的离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D错误;
故选B.
点评:本题考查离子反应方程式书写,明确酸碱中和的实质及离子反应的书写方法即可解答,难度不大.
本题难度:一般