时间:2019-06-28 21:30:04
1、选择题 已知3克乙烷在常温下完全燃烧放出的热量是155.98kJ,则下列乙烷燃烧热的热化学方程式书写正确的是( )
A.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H ="-2119.6" kJ/mol
B.C2H6(g)+5/2O2(g)=2CO2(g)+3H2O(g)△H ="-1559.8kJ/mol"
C.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(g)△H ="-1559.8" kJ/mol
D.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l)△H ="-1559.8" kJ/mol
2、选择题 在下列各说法中,正确的是(?)
A.对于2SO2(g)+O2(g)  2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
B.热化学方程式中的化学计量数不能用分数表示
C.Zn(s)+H2SO4(aq) =ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能
D.ΔH的大小与热化学方程式的化学计量数无关
3、填空题 (12分)中和热的测定是高中重要的定量实验。取0.55 mol/L的NaOH溶液50 mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题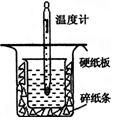
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是_________ _,除此之外,装置中的一个明显错误是 。
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热数值会_________,(填“偏大”、“偏小”或“不变”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求中和热 (填“相等”或“不相等”),简述理由: 。
(4)某实验小组用盐酸和氢氧化钠溶液做了三次实验,每次取溶液各50 mL,并记录下原始数据:
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
| 3 | 25.1 | 25.1 | 25.1 | 27.1 | 2.0 |
4、选择题 下列说法正确的是( ? )
A.第二周期元素的第一电离能随原子序数递增依次增大
B.卤族元素中氟的电负性最大
C.CO2、SO2都是直线形的非极性分子
D.CH2===CH2分子中共有四个σ键和一个π键
5、选择题 能用离子方程式H++OH-=H2O表示的反应是
A.稀醋酸和氢氧化钾反应
B.硫酸氢钠和烧碱溶液反应
C.稀盐酸和氢氧化铜反应
D.稀硫酸和氢氧化钡溶液反应