时间:2019-06-28 21:04:19
1、选择题 物质的量浓度相同的下列溶液中,NH4+浓度最大的是(? )
A.NH4Cl
B.NH4HSO4
C.CH3COONH4
D.NH4HCO3
参考答案:B
本题解析:四个选项中,均存在铵根的水解平衡;
B中NH4HSO4电离出的H+抑制铵根的水解平衡,使NH4+浓度增大;
C中CH3COO-的水解平衡促进铵根的水解平衡,使NH4+浓度减小;
D中HCO3-的水解平衡促进铵根的水解平衡,使NH4+浓度减小;
本题难度:一般
2、填空题 水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如下图所示: 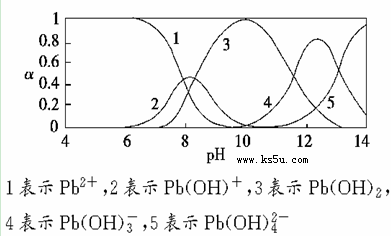
(1)Pb(NO3)2溶液中,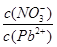 ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,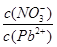 增加,可能的原因是________________________________。
增加,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有__________,pH=9时主要反应的离子方程式为_______________________。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg·L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg·L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
 E2Pb(s)+2H+则脱铅的最合适pH范围为(? )
E2Pb(s)+2H+则脱铅的最合适pH范围为(? )参考答案:(1)>?Pb2+与Cl-反应,Pb2+浓度减少
(2)Pb2+、Pb(OH)+、H+? Pb(OH)++OH- Pb(OH)2
Pb(OH)2
(3)Fe3+? (4)B
本题解析:(1)因为Pb(NO3)2是一种强酸弱碱盐,在水溶液中存在如下水解平衡:2H2O+Pb2+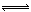 Pb(OH)2+2H+,使c(Pb2+)减小,所以
Pb(OH)2+2H+,使c(Pb2+)减小,所以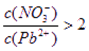 ;滴入氯化铵溶液后,Pb2+与Cl?反应生成难溶的PbCl2,所以Pb2+浓度减少。
;滴入氯化铵溶液后,Pb2+与Cl?反应生成难溶的PbCl2,所以Pb2+浓度减少。
(2)pH=8时,曲线上1、2、3表示的物质共存,所以此时溶液中存在的阳离子(Na+除外)有Pb2+、Pb(OH)+和H+。pH=9时,曲线2、3表示的物质共存,由图可知Pb(OH)2的浓度分数比Pb(OH)+的大,所以主要反应是生成Pb(OH)2,离子方程式为:Pb(OH)++OH- Pb(OH)2。
Pb(OH)2。
(3)分析比较表中所给数据可知Cu2+、Mn2+、Cl-的浓度都降低不到原浓度的1/2,而Fe3+却降低为原浓度的1/3,故对Fe3+的去除效果最好。
(4)由所给平衡可知,要使脱铅效果好,铅应以Pb2+的形式存在,pH<7,而c(H+)增大时2EH(s)+Pb2+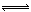 E2Pb(s)+2H+又会向逆反应方向移动,c(H+)不宜过大,所以脱铅最适宜的pH为6~7。
E2Pb(s)+2H+又会向逆反应方向移动,c(H+)不宜过大,所以脱铅最适宜的pH为6~7。
本题难度:一般
3、选择题 Al3+ + 3H2O Al(OH)3 + 3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH值增大,应采取的措施是?
Al(OH)3 + 3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH值增大,应采取的措施是?
A.加热
B.加适量NaOH溶液
C.通入氯化氢气体
D.加入固体三氯化铝
参考答案:B
本题解析:水解吸热,加热促进水解,溶液的pH降低,A不正确;氢氧化钠能结合氢离子,降低氢离子的浓度,常见水解,B正确;C中增大氢离子的浓度,抑制水解,不正确;D中氧化铝不溶于水,对水解平衡几乎没有影响,不正确,答案选B。
点评:该题是中等难度试题的考查,也是高考中的常见题型和考点。该题的关键是明确氯化铝的水解平衡特点,然后结合题意灵活运用勒夏特列原理即可,难度不大。
本题难度:一般
4、选择题 下列反应不属于水解反应或水解方程式不正确的是
①HCl+H2O H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③Na2CO3+2H2O H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3-+H2O=CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O NH3·D2O+H+
NH3·D2O+H+
A.①②③④
B.①②③
C.②③⑤
D.全部
参考答案:D
本题解析:①中是电离,HCl是强电解,不能用“ ”, ①错;②是水解,但水解程度微弱,不能用“=”, ②错;③中CO32-水解应分步进行,两步水解不能合并,因为水解的程度有很大差别,③错;④中是电离,不能用“=”, ④错;⑤中NH4+在水解时,应结合OD-,离子方程式应为NH4++D2O
”, ①错;②是水解,但水解程度微弱,不能用“=”, ②错;③中CO32-水解应分步进行,两步水解不能合并,因为水解的程度有很大差别,③错;④中是电离,不能用“=”, ④错;⑤中NH4+在水解时,应结合OD-,离子方程式应为NH4++D2O NH3·HDO+D+,⑤也错;答案选D。
NH3·HDO+D+,⑤也错;答案选D。
本题难度:一般
5、填空题 常温下的两种溶液① 0.1 mol/L NH3·H2O ② 0.1 mol/L NH4Cl中:
(1)溶液①的pH_______7(填“>”、“<”或“=”),其原因是___________________(用离子方程式表示)。
(2)溶液②呈_______性(填“酸”、“碱”或“中”)。已知水解反应是吸热反应,所以升温可以
______(填“促进”或“抑制”)NH4Cl 溶液的水解。
(3)两种溶液中c(NH4+)的大小关系为_____________(填字母)。
A.两种溶液中c(NH4+)都等于0.1 mol/L
B.两种溶液中c(NH4+)都小于0.1 mol/L
C.NH4Cl溶液中c(NH4+)小于NH3·H2O溶液中c(NH4+)
参考答案:(1)>;NH3·H2O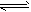 NH4+ +OH-
NH4+ +OH-
(2)酸;促进
(3)B
本题解析:
本题难度:一般