时间:2019-06-28 21:04:19
1、选择题 将标况下的2.24LCO2通入150mL 1mol/LNaOH溶液中,下列说法正确的是
A.c(Na+)等于c(CO32-)与c(HCO3-)之和
B.c(HCO3-) 等于c(CO32-)
C.c(HCO3-) 略大于c(CO32-)
D.c(HCO3-) 略小于c(CO32-)
参考答案:C
本题解析:标况下的2.24LCO2的物质的量为0.1mol;150mL 1mol/LNaOH溶液的物质的量为0.15mol,设反应后溶液中碳酸钠的物质的量为x,碳酸氢钠的物质的量为y;根据C元素守恒可得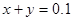 ;根据Na元素守恒可得
;根据Na元素守恒可得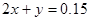 ;解得
;解得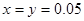 ,由于在溶液中碳酸根离子、碳酸氢根离子均要水解且碳酸根离子的水解程度大于碳酸氢根离子,所以正确选项为C;
,由于在溶液中碳酸根离子、碳酸氢根离子均要水解且碳酸根离子的水解程度大于碳酸氢根离子,所以正确选项为C;
本题难度:一般
2、选择题 欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,其方法是
[? ]
参考答案:D
本题解析:
本题难度:一般
3、填空题 (Ⅰ)化学平衡移动原理,同样也适用于其他平衡
(1)已知在氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O  NH+OH-
NH+OH-
向氨水中加入MgCl2固体时,平衡向 ?移动,OH-的浓度?
向浓氨水中加入少量NaOH固体,平衡向?移动,此时发生的现象是___________。
(2)氯化铁水解的离子方程式为___________________,向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程式为________________,同时有红褐色沉淀生成,其原因是?
(3)向Mg(OH)2的悬浊液中加入NH4Cl溶液,现象?,原
因为?
(Ⅱ)某二元酸 H2A 的电离方程式是:H2A=H++HA,HA- A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
(1)H2A是?(填“强电解质”或“弱电解质”或“非电解质”)
(2)Na2A 溶液显?(填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示)?;
(3)NaHA 溶液显?(填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示)?;
(4)若 0.1mol·L-1NaHA 溶液的 pH=2,则 0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能? 0.11mol·L(填“<”、“>”或“=”),理由是:?;
(5)0.1mol·L NaHA溶液中各离子浓度由大到小的顺序是?。
参考答案:(Ⅰ)(1)右?减小?左?有刺激性气体产生?
(2)Fe3+? + 3H2O Fe(OH)3? + 3H+ ?、 CaCO3 + 2H+===?Ca2+ + H2O +CO2↑?
Fe(OH)3? + 3H+ ?、 CaCO3 + 2H+===?Ca2+ + H2O +CO2↑?
碳酸钙消耗H+ ,促进氯化铁的水解,使水解产物Fe(OH)3大量生成,形成红褐色沉淀
(3)浊液逐渐溶解 溶液中存在平衡 Mg(OH)2 (S)  ?Mg2+(aq)+2OH-(aq) ,加入NH4Cl溶液会发生OH-+NH4+=NH3·H2O?,导致平衡向溶解方向移动,故悬浊液逐渐溶解
?Mg2+(aq)+2OH-(aq) ,加入NH4Cl溶液会发生OH-+NH4+=NH3·H2O?,导致平衡向溶解方向移动,故悬浊液逐渐溶解
(Ⅱ)(1)强电解质?
(2)碱性? A2-+H2O HA-+OH-?
HA-+OH-?
(3)酸性? HA— H++ A2—
H++ A2—
(4)<?因H2A第1步电离产生的H+抑制HA-的电离?
(5)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
本题解析:(1)对于平衡NH3+H2O NH3·H2O
NH3·H2O  NH+OH-来讲,向氨水中加入MgCl2固体时:Mg2++2OH-=Mg(OH)2↓,OH-浓度减小,平衡向右移移动;向浓氨水中加入少量NaOH固体时,OH-浓度增大,平衡向左移动,同时由于溶解过程中放出大量的热:NH3·H2O
NH+OH-来讲,向氨水中加入MgCl2固体时:Mg2++2OH-=Mg(OH)2↓,OH-浓度减小,平衡向右移移动;向浓氨水中加入少量NaOH固体时,OH-浓度增大,平衡向左移动,同时由于溶解过程中放出大量的热:NH3·H2O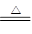 NH3↑+H2O,故有刺激性气体逸出
NH3↑+H2O,故有刺激性气体逸出
(2)氯化铁水解的离子方程式为Fe3+? + 3H2O Fe(OH)3? + 3H+,当向氯化铁溶液中加入碳酸钙粉末,CaCO3 + 2H+===?Ca2+ + H2O +CO2↑,H+浓度减小,平衡向正向移动,使水解产物Fe(OH)3大量生成,故有红褐色Fe(OH)3沉淀生成
Fe(OH)3? + 3H+,当向氯化铁溶液中加入碳酸钙粉末,CaCO3 + 2H+===?Ca2+ + H2O +CO2↑,H+浓度减小,平衡向正向移动,使水解产物Fe(OH)3大量生成,故有红褐色Fe(OH)3沉淀生成
(3)溶液中存在溶解平衡:Mg(OH)2 (S)  ?Mg2+(aq)+2OH-(aq) ,加入NH4Cl溶液会发生OH-+NH4+=NH3·H2O?,导致平衡向溶解方向移动,故悬浊液逐渐溶解
?Mg2+(aq)+2OH-(aq) ,加入NH4Cl溶液会发生OH-+NH4+=NH3·H2O?,导致平衡向溶解方向移动,故悬浊液逐渐溶解
(Ⅱ)(1)H2A全部电离为离子,故为强电解质
(2)由于HA-在溶液中存在平衡:HA- A2-+H+,故Na2A电离出的A2-可水解使溶液呈碱性:A2-+H2O
A2-+H+,故Na2A电离出的A2-可水解使溶液呈碱性:A2-+H2O HA-+OH-
HA-+OH-
(3)NaHA电离出的HA—是强酸H2A对应的离子,不水解,但可电离使溶液呈酸性:HA— H++ A2—,故NaHA溶液为酸性
H++ A2—,故NaHA溶液为酸性
(4)0.1mol·L-1NaHA 溶液中c(H+)=0.01mol·L-1;0.1mol·L-1 H2A溶液可全部电离:H2A=H++HA—,所产生的c(H+)、c(HA—)为0.1mol·L-1,由于H2A第1步电离产生的H+抑制HA-的电离,故c(HA—)离子出的c(H+)必定小于0.01mol·L-1,溶液中c(H+)必定小于0.11mol·L-1
(5)0.1mol·L NaHA溶液中主要存在的离子为c(Na+)、c(HA-),由于c(HA-)部分电离,c(Na+)>c(HA-),溶液呈酸性,同时由于H2O H++OH-,故c(H+)>c(A2-)>c(OH-),则 NaHA溶液中各离子浓度由大到小的顺序是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
H++OH-,故c(H+)>c(A2-)>c(OH-),则 NaHA溶液中各离子浓度由大到小的顺序是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
本题难度:简单
4、选择题 常温下,将等体积、等物质的量浓度的NaOH溶液和CH3COOH溶液混合,混合液呈
A.中性
B.碱性
C.酸性
D.无法确定
参考答案:B
本题解析:等体积等浓度的氢氧化钠溶液和醋酸溶液混合,恰好中和生成醋酸钠,醋酸钠水解溶液呈碱性。
点评:理解盐类水解的本质:盐电离出来的离子与水电离出来的H+或OH-结合生成弱电解质,破坏水的电离平衡。
本题难度:一般
5、填空题 (4分)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可以降低土壤的碱性。试用化学方程式分别表示盐碱地产生碱性的原因:?,及用石膏降低其碱性的反应原理:?。
参考答案:(4分) Na2CO3 + H2O= NaOH+NaHCO3?Na2CO3 +CaSO4= Na2SO4+CaCO3↓
本题解析:碳酸钠是强碱弱酸盐,溶于水水解显碱性,水解方程式是Na2CO3 + H2O= NaOH+NaHCO3;石膏是硫酸钙,能和碳酸钠反应生成难溶性的碳酸钙沉淀,从而抑制水解,反应的化学方程式是Na2CO3 +CaSO4= Na2SO4+CaCO3↓。
点评:本题关键是要从平衡的角度去理解如何降低溶液的酸碱性,因此要利用勒夏特例原理。
本题难度:简单