时间:2019-06-25 23:36:55
1、计算题 将6g纯铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中充分反应后得到200mL0.5mol/L的FeSO4溶液和5.2g固体,求: (1)反应后生成铜多少克?
(1)反应后生成铜多少克? (2)加入铁粉前Fe2(SO4)3物质的量浓度。
(2)加入铁粉前Fe2(SO4)3物质的量浓度。
参考答案:(1)2.56g(2)0.1mol/L
本题解析: 发生反应的化学方程式为:
发生反应的化学方程式为: ①Fe+Fe2(SO4)3=3FeSO4?②Fe+CuSO4=Cu+FeSO4
①Fe+Fe2(SO4)3=3FeSO4?②Fe+CuSO4=Cu+FeSO4 两个反应共生成FeSO4为:0.2L×0.5mol/L=0.1mol
两个反应共生成FeSO4为:0.2L×0.5mol/L=0.1mol 观察两个反应不难发现,若生成同样的FeSO4,②式消耗的铁更多。假设0.1molFeSO4全部为②式产生,则此时消耗的铁将达最大量为a。
观察两个反应不难发现,若生成同样的FeSO4,②式消耗的铁更多。假设0.1molFeSO4全部为②式产生,则此时消耗的铁将达最大量为a。



 ?
? ?Fe?~? FeSO4
?Fe?~? FeSO4 ? 1mol? 1mol
? 1mol? 1mol ? a? 0.1mol
? a? 0.1mol a=0.1mol,即铁为5.6g,则5.2g固体中含Cu也含剩余的Fe,设原溶液的Fe2(SO4)3和CuSO4的物质的量分别为x和y。
a=0.1mol,即铁为5.6g,则5.2g固体中含Cu也含剩余的Fe,设原溶液的Fe2(SO4)3和CuSO4的物质的量分别为x和y。 Fe+Fe2(SO4)3=3FeSO4? Fe+CuSO4=Cu+FeSO4
Fe+Fe2(SO4)3=3FeSO4? Fe+CuSO4=Cu+FeSO4 X? x? 3x? y? y? y? y
X? x? 3x? y? y? y? y
 由题意得? 3x+y=0.1mol
由题意得? 3x+y=0.1mol ? 6g-56g/mol×(x+y)+64g/mol×y=5.2g
? 6g-56g/mol×(x+y)+64g/mol×y=5.2g 解得:x="0.02mol?" y=0.04mol
解得:x="0.02mol?" y=0.04mol 则生成铜:0.04mol×64g/mol=2.56g
则生成铜:0.04mol×64g/mol=2.56g 原Fe2(SO4)3和物质的量浓度为0.02mol/0.2L=0.1mol/L
原Fe2(SO4)3和物质的量浓度为0.02mol/0.2L=0.1mol/L
本题难度:一般
2、填空题 铜是重要的金属材料.
(1)工业上可用Cu2S和O2反应制取粗铜,化学方程式为?,该反应中氧化剂为________?.
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4<________mol.
(3)电子工业曾用30%的FeCl3溶液腐蚀覆盖铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得FeCl3溶液,设计如下实验流程.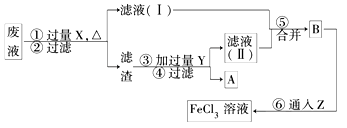
上述流程中,所加试剂的化学式为:
X________________,Y____________,Z____________;
第⑥步反应的离子方程式为___________________________?
参考答案:(1)Cu2S? +? O2 =2Cu? +? SO2? O2? ,.Cu2O?(2)0.9
(3) X? Fe? Y? HCl? Z? Cl2? 2Fe 2+ + Cl2 ==? 2Fe 3+ + 2Cl-
本题解析:(1)根据物质的组成可知,生成物除铜以外,还与SO2生成,所以反应的方程式是Cu2S? +? O2 =2Cu? +? SO2;根据方程式可知,氧元素和铜元素的化合价都是降低的,所以氧化剂是O2和Cu2O。
(2)由于在反应过程中,硫酸的浓度逐渐降低,而稀硫酸和铜是不反应的,所以被还原的硫酸小于0.9mol。
(3)溶液中还原氯化铜、氯化铁、氯化亚铁,所以首先加入足量的铁粉置换出铜,即X是铁。由于铁过量,所以在金属混合物中加入盐酸溶解铁,过滤、洗涤干燥即得到铜,因此Y是盐酸。要把氯化亚铁变成氯化铁,则需要通入氯气,则Z是氯气,反应的离子方程式是2Fe 2+ + Cl2 ="=" 2Fe 3+ + 2Cl-。
本题难度:一般
3、实验题 FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下: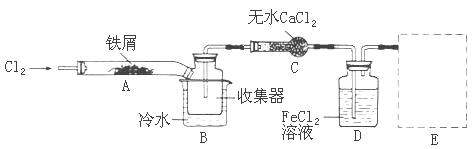
①检查装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成
④ ……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封
请回答下列问题:
(1)写出FeCl3溶液吸收有毒的H2S的离子方程式为?
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是?
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)?
(4)装置B中的冷水作用为?;装置C的名称为?;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,从下面选出检验FeCl2是否完全失效的试剂:___?
A.氢氧化钠溶液
B.酸性高锰酸钾溶液
C.硫氰化钾溶液
D.氨水
(5)在虚线框内画出尾气吸收装置E并注明试剂。
参考答案:(1)2Fe3++H2S=2Fe2++S↓+2H+(2分)
(2)在沉积的的FeCl3固体下方加热。(2分)
(3)②、⑤(2分)
(4)冷却FeCl3使其沉积,便于收集产品(2分);干燥管(2分);B(2分)
(5)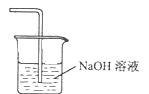
本题解析:(1)发生氧化还原反应:2Fe3++H2S=2Fe2++S↓+2H+;(2)结合题目信息——FeCl3易升华来看,在沉积的FeCl3固体下方加热即可将其转化为气态,再在气流作用下,带入B中凝华;(3)装置干燥,通入的气体干燥均可防止其潮解,故步骤中②⑤合题意;(4)冷却,使FeCl3沉积,便于收集产品;C为干燥管;是否失效就是要检验Fe2+还有无,最佳试剂为酸性高锰酸钾溶液,能使高锰酸钾褪色;(5)过量Cl2用NaOH溶液吸收;3+和Fe2+的性质。
本题难度:一般
4、填空题 在试管里放入一块铜片,注入一定体积的浓硫酸,给试管加热,使之反应。
(1)若铜片还有剩余,硫酸__? __消耗完毕(填“已”或“没有”)。其理由是?
?。
(2)用一定量的废铜屑制取胆矾,有两种方法:第一种是取Cu与浓H2SO4直接反应;第二种是先将铜在空气中加热使之生成CuO,再与稀H2SO4反应,其中_?_种方法好,理由是____? ____。
参考答案:1)没有,(2分)
铜只与浓硫酸反应,随着反应进行,浓硫酸变稀就不与铜反应了(2分)
(2) 第二(2分)
节省原料且又环保(2分)
本题解析:略
本题难度:简单
5、选择题 对实验Ⅰ~Ⅳ的实验现象判断正确的是( )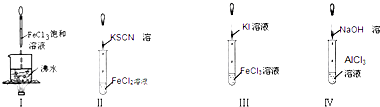
A.实验Ⅰ:产生红褐色沉淀
B.实验Ⅱ:溶液变红色
C.实验Ⅲ:试管中溶液变浅黄色
D.实验Ⅳ:试管中先出现白色沉淀,后溶解
参考答案:D
本题解析:
本题难度:简单