时间:2019-06-25 23:36:55
1、填空题 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验“.
请回答该实验中的问题.
(1)写出该反应的化学方程式______.
(2)实验前必须对整套装置进行的操作是______.
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是______.
(4)试管中要收集干燥的气体,干燥管中盛装的物质是______,作用是______.
(5)试管中收集到的气体是______,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行______,这一操作的目的是______.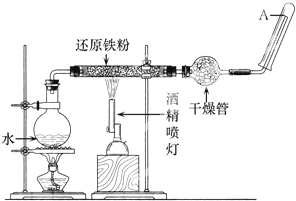
参考答案:(1)铁与水蒸气发生氧化还原反应:3Fe+4H2O ?△?.?Fe3O4+4H2,故答案为:3Fe+4H2O ?△?.?Fe3O4+4H2;
(2)实验前必须对整套装置进行气密性检查,故答案为:检验装置的气密性;
(3)因为反应物为水蒸气与铁,所以这里加热的目的就是提供水蒸气,故答案为:为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气;
(4)干燥氢气可以用碱石灰干燥剂,故答案为:碱石灰;除去反应产生的H2中的水蒸气;
(5)铁与水蒸气发生氧化还原反应生成氢气,点燃氢气前一定要检验纯度,防止发生爆炸.故答案为:氢气;验纯;防止点燃时,氢气因含有氧气而爆炸.
本题解析:
本题难度:一般
2、选择题 向一定量的Fe、FeO和Fe2O3的混合物中加入120mL?4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为
A.0.24mol
B.0.21mol
C.0.25mol
D.0.12mol
参考答案:B
本题解析:n(HNO3)=0.12L×4mol/L=0.48mol,n(NO)=1.344L÷22.4L/mol=0.06mol,往所得溶液中加入KSCN溶液,无红色出现,说明全部生成Fe2+,溶液溶质为Fe(NO3)2,则原混合物中Fe为(0.48mol-0.06mol)÷2==0.21mol,则若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为0.21mol,故选B。
本题难度:一般
3、选择题 下列说法中,正确的是
A.利用铁加入硫酸铜溶液中的反应可以比较Cu、Fe2+的还原性
B.足量的铜跟一定量的浓硝酸反应只产生一种气体
C.氮的固定只有在高温、高压、催化剂的条件下才能实现
D.以铁为阴极、铜片为阳极、硫酸铜为电镀液可以实现铁制品镀铜
参考答案:D
本题解析:A、利用铁加入硫酸铜溶液中的反应可以比较Cu、Fe的还原性,错误;B、随着反应的进行,浓硝酸浓度逐渐减小而变为稀硝酸,所以可得到NO2、NO气体,错误;C、N2与O2的反应条件是放电,错误;D、电镀时,镀层金属为阳极,电镀液为含镀层金属阳离子的溶液,正确。
本题难度:一般
4、填空题 将一定量的Fe粉、Cu粉、FeCl3溶液、CuCl2溶液混合于某容器中充分反应(假定容器不参与反应),试判断下列情况下容器中金属离子与金属单质的存在情况:
(1)若Fe粉有剩余,则容器中不可能有____________
(2)若FeCl3有剩余,则容器中不可能有___________
(3)若CuCl2有剩余,则容器中还可能有________________________
(4)若FeCl3和CuCl2都有剩余,则容器中还可能有______________
参考答案:(4分)? (1)Fe3+和Cu2+? (2)Fe和Cu? (3)Fe2+、Fe3+或Cu、Fe2+? (4)Fe2+
本题解析:(1)由于氯化铁、氯化铜都能氧化单质铁,所以若Fe粉有剩余,则容器中不可能有Fe3+和Cu2+。
(2)由于氯化铜既能氧化单质铁,也能氧化单质铜,所以若FeCl3有剩余,则容器中不可能有Fe和Cu。
(3)由于氯化铜只能氧化单质铁,所以若CuCl2有剩余,则容器中还可能有Fe2+、Fe3+或Cu、Fe2+。
(4)由于氯化铁、氯化铜都能氧化单质铁,而氯化铁还能氧化单质铜,所以若FeCl3和CuCl2都有剩余,则容器中还可能有Fe2+。
本题难度:一般
5、实验题 某研究小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略)。
(1)MgCO3的分解产物为________。
(2)装置C的作用是_____________________________________________________,
处理尾气的方法为_______________________________________________________。
(3)将研究小组分为两组,按如图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
(已知:Fe2+与K3[Fe(CN)6]反应产生蓝色沉淀)。
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
参考答案:(1)MgO、CO2 (2)除CO2 点燃
(3)①Fe ②Fe3O4+8H+=2Fe3++Fe2++4H2O ③Fe2+被氧化为Fe3+,Fe3+遇SCN-显红色 假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立(其他合理答案即可) ④在装置BC之间添加装置E防倒吸(其他合理答案均可)
本题解析:本题考查CO与氧化铁反应的探究实验,意在考查考生对化学实验的设计与评价能力。(1)MgCO3的分解类似于CaCO3。(2)Zn粉与CO2反应制备CO时,CO2可能过量,C中氢氧化钠溶液可将过量的CO2除去。尾气中的CO会污染空气,可用点燃的方法除去。(3)①根据表格中的信息可知,甲、乙两组实验所得黑色固体分别是Fe3O4、Fe。②Fe3O4可视为FeO·Fe2O3。FeO、Fe2O3与盐酸反应的化学方程式分别为FeO+2HCl=FeCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O,叠加得Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,改写成离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O。③乙组实验步骤3得到的溶液中含有Fe2+而无Fe3+,滴加新制氯水变红是由于Fe2+被氧化为Fe3+,溶液随后褪色,可能是由于Cl2将SCN-氧化,欲验证此结论是否正确,可向溶液中重新滴加KSCN溶液,观察是否重新出现红色。若出现红色,则假设成立,否则不成立。④B装置温度较高,若发生倒吸,则会造成玻璃管炸裂,因此可在装置BC之间增加防倒吸装置。
本题难度:一般