时间:2019-06-25 22:31:57
1、填空题 (5分)为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中。
| 题号 | 实验要求 | 答案 |
| (1) | 从碘水中提取碘单质 | ? |
| (2) | 提纯混有少混NaCl的KNO3 | ? |
| (3) | 鉴别NaCl和KCl | ? |
| (4) | 测定某工业废水的酸碱度 | ? |
| (5) | 检验自来水中残余氯分子 | ? |

参考答案:(5分)
(1)C (2)B (3)A (4)D (5)E?(各1分,共5分)
本题解析:略
本题难度:一般
2、实验题 (每空2分,共12分).
(1)下列说法不正确的是??。
A.用100mL的容量瓶准确量取100mL液体
B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
C.用托盘天平称量NaCl固体时,NaCl放在称量纸上,称量NaOH固体时,NaOH放在小烧杯里
(2)回答下列问题(填序号):
下列仪器中:①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥量筒⑦燃烧匙。
常用于物质分离的是?,其中根据物质沸点不同来分离物质的仪器是?。
(3)用适当的试剂或方法除去下列物质中所混有的少量杂质,写出有关的反应方程式。
铁粉中混有少量铝粉?;
FeCl3中混有少量FeCl2?;
固体 Na2CO3中混有少量NaHCO3?。
参考答案:(每空2分,共12分)?(1)A
(2)①③⑤,③? (3)? 2A1+2NaOH+2H2O=2NaAl02+3H2↑
2FeCl2+Cl2=2FeCl3?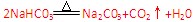
本题解析:⑴容量瓶是作为配制一定物质的量浓度溶液的专用仪器,不用作液体体积的量取,不正确;B正确;NaOH易潮解,称量时NaOH放在小烧杯里,正确。
⑵过滤用于不溶性的固体与液体分离、蒸馏是分离相溶沸点相差较大的液体混合物、分液是分离互不相溶的液体的方法,因此用于物质分离的是漏斗、蒸馏烧瓶、分液漏斗;
⑶根据铝与氢氧化钠反应而铁不与其反应,可用氢氧化钠除去铝;利用Cl2与FeCl2反应生成FeCl3而除去FeCl2;利用NaHCO3受热分解产生Na2CO3而采取加热的方法。
本题难度:一般
3、实验题 现拟用图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量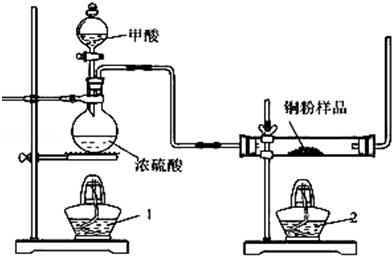
(1)制备一氧化碳的化学方程式是 ? ;
(2)试验中,观察到反应管中发生的现象是 ? ;尾气的主要成分是 ? ;
(3)反应完成后,正确的操作顺序为 ? (填字母)
a.关闭漏斗开关? b.熄灭酒精1? c.熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为 ? ;
(5)从浓硫 酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节) ? ;
②写出有关反应的化学方程式 ? .
参考答案:(1)HCOOH CO↑+H2O(2)样品由黑色变红色;CO、CO2(3)cab(4)80%(5)将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;CuO+H2SO4=CuSO4+H2O
CO↑+H2O(2)样品由黑色变红色;CO、CO2(3)cab(4)80%(5)将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;CuO+H2SO4=CuSO4+H2O
本题解析:(1)甲酸在浓硫酸、加热的条件下分解生成CO与H2O;
(2)实验中,反应管中发生反应CuO+CO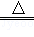 Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;
Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;
(3)实验步骤:先通入CO一会儿后,加热待反应管内的药品完全后,停止加热,然后继续通入CO到玻璃管冷却为止;
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,剩余固体全部为铜,利用差量法计算出原样品中氧化铜的质量,进而计算铜的质量分数;
(5)①要测定铜的质量分数,可以把浓硫酸稀释,铜和稀硫酸不反应,氧化铜和稀硫酸反应,即可求出铜的质量分数.设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可.②反应的化学方程式为CuO+H2SO4=CuSO4+H2O.
解:(1)甲酸在浓硫酸、加热的条件下分解生成CO与H2O,反应方程式为HCOOH CO↑+H2O;
CO↑+H2O;
故答案为:HCOOH CO↑+H2O;
CO↑+H2O;
(2)实验中,反应管中发生反应CuO+CO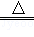 Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;
Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;
故答案为:样品由黑色变红色;CO、CO2;
(3)反应完后,操作顺序先撤酒精灯2,此时左边装置仍在制取CO,然后再关闭分液漏斗的开关,不再加入反应试剂,最后撤酒精灯1停止反应,这样操作防止空气中O2进入右边装置铜又被氧化为氧化铜了,正确的操作顺序为:熄灭酒精灯2,关闭漏斗开关,最后熄灭酒精1,即cab;
故答案为:cab;
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,剩余固体全部为铜,令样品中CuO的质量为m,则:
CuO+CO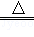 Cu+CO2,固体质量减少△m
Cu+CO2,固体质量减少△m
80? 16
m? 5g﹣4.8g=0.2g
故m=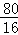 ×0.2g=1g,
×0.2g=1g,
所以原样品中金属铜的质量分数为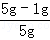 ×100%=80%;
×100%=80%;
故答案为:80%;
(5)①要测定铜的质量分数,可以把浓硫酸稀释,铜和稀硫酸不反应,氧化铜和稀硫酸反应,即可求出铜的质量分数.设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;
故答案为:将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;
②反应的化学方程式为CuO+H2SO4=CuSO4+H2O;
故答案为:CuO+H2SO4=CuSO4+H2O.
点评:本题考查学生对实验原理与实验操作的理解、实验方案设计、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.
本题难度:一般
4、选择题 下列实验能达到实验目的且符合安全要求的是( )
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠, 小心放入装满水的烧杯中。 |
| B | 制备并检验氢气的可燃性 | 锌粒与稀硫酸反应产生气体,立即点燃。 |
| C | 用浓硫酸制稀硫酸 | 把水沿器壁倒入装有浓硫酸的烧杯中,并用玻璃 棒不断搅拌。 |
| D | 一氧化碳还原氧化铜 | 用石灰水检验气体产物,实验结束时先从水槽中 取出导管,再熄灭酒精灯。 参考答案:D 本题解析:A不正确,应该用滤纸吸干表面的煤油;B不正确,点燃前需要检验氢气的纯度;C不正确,应该将浓硫酸沿器壁倒入装有水的烧杯中,并用玻璃棒不断搅拌,所以正确的答案选D。 本题难度:简单 5、选择题 某混合气体中可能含有Cl2、O2、SO2、NO、NO2、CO2中的两种或多种气体.现将此无色的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色.对于原混合气体成分的判断中错误的是( ) 参考答案:该气体是无色的,则一定不能含有氯气(黄绿色)和NO2(红棕色).混合气体通过品红溶液后,品红溶液褪色,说明含有SO2.把剩余气体排入空气中,很快变为红棕色,说明含有NO,因此一定不能含有O2,由于没有涉及到二氧化碳的性质和现象,则不能确定是否含有二氧化碳. 本题解析: 本题难度:简单 |