时间:2019-06-25 21:42:32
1、选择题 对于常温下pH=2的盐酸和pH=3的醋酸,下列说法正确的是
A.pH=2的盐酸中:c(H+)=c(Cl-) + c(OH-)
B.pH=3的醋酸中:c(H+)=3.0 mol·L-1
C.pH=2的盐酸与pH=3的醋酸中溶质的物质的量浓度之比为10:1
D.pH=3的醋酸与pH=11的NaOH溶液等体积混合所得溶液中:c(Na+)=c(CH3COO-)
参考答案:A
本题解析:A项满足电荷守恒,正确;B项在pH=3的醋酸中c(H+)=1×10-3mol·L-1,错误;C项由于醋酸为弱酸,发生部分电离(存在电离平衡),错误;D项pH=3的醋酸与pH=11的NaOH溶液等体积混合所得溶液中醋酸过量,溶液显酸性,据电荷守恒得c(Na+)<c(CH3COO-),错误。
本题难度:简单
2、选择题 部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡 常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
参考答案:B
本题解析:根据电离常数可知酸性HCOOH>H2CO3>HCN>HCO3-,A错误,B正确;等浓度时,NaCN的水解程度大于HCOONa的水解程度,因此NaCN溶液的pH大于HCOONa溶液的pH,C错误;等浓度的HCOONa溶液和NaCN溶液,各自的体积未知,消耗的NaOH的量也就不确定,D错误。
本题难度:一般
3、选择题 某温度下,体积和pH均相同的氢氧化钠溶液和氨水分别加水稀释,溶液的pH随溶液体积(V)变化的曲线如图所示,则下列判断中正确的是( )
A.I是氨水的pH变化曲线
B.b、c两点溶质的浓度相等
C.中和a点时氨水和氢氧化钠溶液所需硫酸的物质的量相等
D.c→d的变化过程中,溶液中所有离子的浓度均减小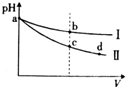
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列事实说明HNO2为弱电解质的是
①0.1 mol/L HNO2溶液的pH=2.1; ②常温下NaNO2溶液的pH>7 ;
③用HNO2溶液做导电实验时,灯泡很暗; ④HNO2溶液和KCl溶液不发生反应
⑤HNO2能与碳酸钠反应制CO2; ⑥HNO2不稳定,易分解
A.①②③⑤
B.①②④⑤
C.①②⑥
D.①②
参考答案:D
本题解析:①若亚硝酸为强酸,则0.1mol/L的亚硝酸溶液的pH=1,而实际为2.1,所以可以说明亚硝酸为弱酸,正确;②若亚硝酸为强酸,则亚硝酸钠溶液在常温下的pH=7,溶液为中性,而实际pH>7,溶液呈碱性,说明亚硝酸是弱酸,正确;③溶液的导电能力与溶液中的离子浓度有关,与电解质的强弱无关,错误;④亚硝酸与KCl不反应,不能说明亚硝酸是弱酸,若为强酸,也不与KCl反应,错误;⑤HNO2能与碳酸钠反应制CO2,说明亚硝酸比碳酸的酸性强,但不能说明亚硝酸是弱酸,错误;⑥酸的强弱与其稳定性无关,错误,所以答案选D。
考点:考查弱电解质的判断
本题难度:一般
5、选择题 下列图示与对应的叙述相符的是



图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A.图Ⅰ表示t℃时冰醋酸在稀释过程中溶液导电性的变化
B.图Ⅱ表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图Ⅲ表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的大
3C(g)+D(s)的影响,乙的压强比甲的大
D.据图Ⅳ,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
参考答案:D
本题解析:A中,冰醋酸的导电性应该为0,所以A错误;B中,表示的应该为放热反应分别在有、无催化剂的情况下反应过程中的能量变化,不是吸热,所以B错误;C中错在乙的压强比甲的大,因为对可逆反应2A(g)+2B(g) 3C(g)+D(s),压强越大,反应物的百分比就越小,但是最终的百分比并不相等,故C错误;D项则是正确选项
3C(g)+D(s),压强越大,反应物的百分比就越小,但是最终的百分比并不相等,故C错误;D项则是正确选项
考点:化学平衡,电解质的导电,离子水解
点评:该题具有一定的综合性,并且还结合了图像,是高考考查的重点,具有一定的难度。
本题难度:困难