时间:2019-06-25 21:42:32
1、选择题 在0.1 mo l · L-1的NH3·H2O溶液中,下列关系式正确的是(?).
A c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)
B c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
C c(NH3·H2O)>c(NH4+)=c(OH-)>c(H+)?
D c(NH3·H2O)>c(NH4+)>c(H+)>c(OH-)
2、选择题 在100ml下列溶液中,分别加入0.05molNaOH固体,溶液的导电性变化不大的是
A.蒸馏水
B.0.5mol/L的CH3COOH
C.0.5mol/L的HCl
D.0.5mol/L的氨水
3、选择题 用水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是
A.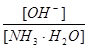
B.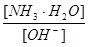
C.[H+]和[OH-]的乘积
D.OH-的物质的量
4、填空题 对于弱酸在-定温度下达到电离平衡时,各粒子的浓度存在一种定量的关系.若在25℃时有HA?H++A-,则K=c(H+)?c(A-)/c(HA),式中K为电离平衡常数,只与温度有关,各粒子的浓度为达到平衡时的浓度.下表是几种常见弱酸的电离平衡常数(25℃)
| 酸 | 点解方程式 | 电离平衡常数 CH3COOH CH3COOH?CH3COO-+H+ K=1.76×10-5 H2CO3 H2CO3?HCO3-+H+ HCO3-?CO32-+H+ K1=4.31×10-7 K2=5.61×10-11 H2S H2S?HS-+H+ HS-?S2-+H+ K1=9.1×10-8 K2=1.1×10-15 H3PO4 H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
5、选择题 室温下,将1.00mol ? L-1盐酸滴人20. OO mL?1.OOmol ? L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如下图所示。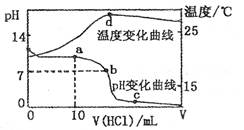
下列有关说法中不正确的是
A.a点溶液中离子浓度大小的关系: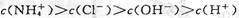
B.b点溶液中离子浓度大小的关系: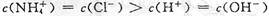
C.c点溶液中离子浓度大小的关系: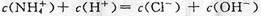
D.d点时溶液温度达到最高,之后温度略有下降,原因是NH3? H2O电离吸热