时间:2019-06-25 20:56:33
1、选择题 在密闭容器中发生反应:aX(g)+bY(g)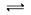 cZ(g)+dW(g)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
cZ(g)+dW(g)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
A.平衡向逆反应方向移动
B.a + b > c + d
C.Z的体积分数减小
D.X的转化率下降
参考答案:B
本题解析:保持温度不变,将气体压缩到原来的1/2体积的瞬间,W的浓度为原平衡的2倍。但当再次达到平衡时,W的浓度为原平衡的1.8倍,这说明增大压强,平衡向逆反应方向移动,即正方应是体积增大的可逆反应,选项ACD正确,B不正确,所以正确的答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,在注重对学生基础知识检验和训练的同时,侧重对学生能力的培养。该题的关键是明确浓度瞬间的变化量和最终浓度变化量的关系,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和创新思维能力。
本题难度:一般
2、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
 2Z,其平衡常数值为1600
2Z,其平衡常数值为1600参考答案:A
本题解析:A、X的转化率为0.05/0.1×100%=50%,正确;B、三种物质的浓度变化量之比为1:3:2,反应可表示为X+3Y 2Z,其平衡常数值
2Z,其平衡常数值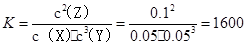 ,正确;C、平衡常数只与温度有关,错误;D、平衡常数只与温度有关,改变温度可以改变此反应的平衡常数,正确。
,正确;C、平衡常数只与温度有关,错误;D、平衡常数只与温度有关,改变温度可以改变此反应的平衡常数,正确。
本题难度:简单
3、填空题 (9分)在一定温度下, 把2molN2和6molH2通入体积不变的容器中。容器中发生以下反应: N2(g) + 3H2(g) 2NH3(g) ,△H= —QKJ/mol。若反应达平衡后, 测得混合气体为7mol。据此回答下列问题:
2NH3(g) ,△H= —QKJ/mol。若反应达平衡后, 测得混合气体为7mol。据此回答下列问题:
保持上述反应温度不变, 设a.b.c分别代表起始加入的N2.H2和NH3的物质的量。如果反应达平衡后混合气体中各物质的百分含量仍与上述平衡时完全相同, 那么:
(1)若a = 1.c =" 2," 则b =?。在此情况下, 反应起始时将向?方向进行(填“正”或“逆”)。
(2)若需规定起始时反应向逆方向进行,则c的范围是?。
参考答案:(1)3 ,?逆 ,
(2)1<c≤4
本题解析:? N2(g) + 3H2(g) 2NH3(g)
2NH3(g)
起始(mol) 2? 6
转化(mol) x? 3x? 2x
平衡(mol)2-x? 6-3x? 2x
8-2x=7,x=0.5mol。
(1)? N2(g) + 3H2(g) 2NH3(g)
2NH3(g)
平衡(mol)? 1.5? 4.5? 1
某时刻(mol)1? b ?2
根据以上数据知b=3,因为反应物的量小于平衡量,说明反应向逆反应进行。
(2)向逆向移动,则氨气的量必须大于平衡量1mol,同时不能高于最大值4mol,范围是1<c≤4。
点评:利用三行式可以快速解决化学平衡计算。
本题难度:一般
4、填空题 工业废水中常含有一定量的Cr2O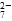 和CrO
和CrO ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为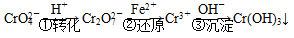
其中第①步存在平衡:
2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O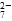 (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的 pH = 2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是________。
a.Cr2O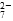 和CrO
和CrO ?的浓度相同
?的浓度相同
b.2v(Cr2O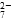 )=v(CrO
)=v(CrO )
)
c.溶液的颜色不变
(3)第②步中,还原 1 mol Cr2O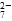 ?离子,需要______mol的FeSO4·7H2O。
?离子,需要______mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法
该法用 Fe 做电极电解含Cr2O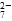 的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
(5)用Fe做电极的原因为______________________________________
(6)在阴极附近溶液 pH 升高的原因是(用电极反应解释)________________,溶液中同时生成的沉淀还有________。
参考答案:(1)橙 (2)c (3)6 (4)5
(5)阳极反应为 Fe-2e-=Fe2+,提供还原剂Fe2+
(6)2H++2e-=H2↑ Fe(OH)3
本题解析:本题主要结合工业废水的处理考查溶液中的平衡问题、氧化还原反应和电解原理的应用等知识,意在考查考生综合运用化学理论知识解决实际问题的能力。
(1)pH = 2 时,反应正向进行的速率较大,溶液呈橙色。
(2)达到平衡状态时,正逆反应速率相等,混合物中各组分浓度保持不变,但不一定相等,溶液的颜色不再发生改变,即只有 c 正确。
(3)根据反应前后 Cr 和 Fe 元素的化合价变化,可确定还原 1 mol Cr2O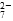 需 6 mol FeSO4·7H2O。
需 6 mol FeSO4·7H2O。
(4)当 c(Cr3+)= 10-5 mol/L时,根据 Ksp的表达式可求出 c(OH-)= 10-9 mol/L,则此时溶液 pH = 5。
(5)用铁做阳极,反应中生成Fe2+,提供还原剂。
(6)阴极 H+得电子生成 H2,随着电解的进行,溶液的 pH逐渐增大,溶液中还会生成 Fe(OH)3沉淀。
本题难度:一般
5、选择题 一定温度下,向恒容密闭容器中通入气体C,发生反应mA(g)+nB(g)  pC(g).能肯定该反应达到平衡状态的标志是( )
pC(g).能肯定该反应达到平衡状态的标志是( )
A.混合气体的密度不随时间改变
B.容器内气体的压强不随时间改变
C.C的分解率不随时间改变
D.v(A)∶v(B)∶v(C)=m∶n∶p
参考答案:C
本题解析:A项:混合气体的质量、体积是定值,所以密度是定值,不能做为判断的标志;B项:两边的气体的系数不知是否相等,故混合气体的总物质的量不知是否相等,所以压强也就不能做为判断标志了;而D项在任何时间都是成立的,不能做为判断标志;故本题答案为C
本题难度:一般