时间:2019-06-25 20:56:33
1、选择题 在2NO2 N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
A.N2O4和NO2的分子数比为1∶2
B.N2O4和NO2的浓度相等
C.平衡体系的颜色不再改变
D.单位时间内有1 mol N2O4变为NO2的同时,有2 mol NO2生成
参考答案:C
本题解析:A、B不能说明可逆反应已达平衡;C颜色不变可作为平衡判据;D中表示的速率方向一致,不能判定反应达到平衡。
本题难度:一般
2、选择题 向新制备的氯水中不断滴入饱和NaCl溶液,则下列曲线符合氯水pH变化的是(? )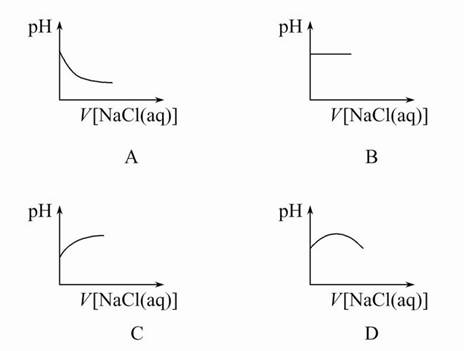
参考答案:C
本题解析:新制氯水中存在的主要平衡是Cl2+H2O H++Cl-+HClO,当加入饱和NaCl溶液时,c(Cl-)增大,使平衡逆向移动,c(H+)减小。
H++Cl-+HClO,当加入饱和NaCl溶液时,c(Cl-)增大,使平衡逆向移动,c(H+)减小。
本题难度:一般
3、选择题 在一定温度下,向a L体积固定的密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g) + 2Y(g)  3Z(g)。下列说法不正确的是
3Z(g)。下列说法不正确的是
A.容器内压强不随时间变化而变化
B.某一时刻,容器内各物质的浓度有可能相等
C.达到平衡时,单位时间内生成3n mol Z,同时生成 2n mol Y
D.X,Y的转化率相等
参考答案:B
本题解析:A正确,该反应为等体积反应,反应前后气体的总物质的量不变,容器内压强不变。
B错,因加入的X、Y的物质的量为1 mol X气体和2 mol Y气体,与化学计量数比值相等,所以,X、Y两物质的转化率相等,变化的量相等,不可能会出现某一时刻,容器内各物质的浓度相等的情况;
C正确,单位时间内生成3n mol Z必消耗Y2n mol,但同时又生成了2n mol Y,Y的浓度不变,即达到了平衡;
D正确,X,Y的转化率相等
本题难度:一般
4、简答题
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g) N2O4(g)?△H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。?其他条件不变时,下列措施不能使NO2转化率提高的是 ??
N2O4(g)?△H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。?其他条件不变时,下列措施不能使NO2转化率提高的是 ??
A.减少NO2的浓度
B.降低温度
C.增加NO2的浓度
D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= ??kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K=?。
N2O4(g)的平衡常数K=?。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 ?。
(5)已知在相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2mol/L?N2H4?H2O溶液与0.1mol/L?HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为:__________。
(6)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是 ??,电池工作一段时间后,电解质溶液的pH将 ?(填“增大”、“减小”、“不变”)。
参考答案:(1)BC
(2)-1224.96
(3)13.3
(4)N2H4+H2O=N2H5++OH-;N2H5++H2O=N2H62++OH-
(5)c(N2H5+)>c(Cl-)>c(OH-)>c(H+)
(6)N2H4+4OH--4e-=4H2O+N2?减少
本题解析:(1)该反应是反应前后气体体积减小的、放热的可逆反应,要使该反应向正反应方向移动,可改变反应物的浓度、体系的压强、温度等。
减小N02的浓度,平衡向逆反应方向移动,NO2的转化率降低,故A错误;
降低温度,平衡向正反应方向移动,NO2的转化率提高,故B正确;
增加NO2的浓度,相当于体系压强增大,利于反应向正反应方向移动,NO2的转化率提高,故C正确;
升高温度,平衡向逆反应方向移动,NO2的转化率降低,故D错误。
(2)1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量,则2molN2O4(l)的质量为2mol×32g/mol=64g,放出热量为19.14kJ×64=1224.96KJ的热量。
(3)平衡时,c(NO2)=0.030?0mol?L-1、c(N2O4)=0.012?0mol?L-1
反应2NO2(g) N2O4(g)的平衡常数
N2O4(g)的平衡常数
k= c(N2O4)/c2(NO2)=0.012?0/0.030?02==13.3。
(4)肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,电离方程式为N2H4+H2O=N2H5++OH-;N2H5++H2O=N2H62++OH-。
(5)将0.2mol/L?N2H4?H2O溶液与0.1mol/L?HCl溶液等体积混合,得到等量的N2H4?H2O、N2H5C1,由相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度,则c(N2H5+)>c(Cl-),又溶液显碱性,即c(OH-)>c(H+),电离、水解的程度都不大,所以c(N2H5+)>c(Cl-)>c(OH-)>c(H+)。
(6)燃料电池中负极上投放的是燃料肼,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H4+4OH--4e-=4H2O+N2;反应过程中生成水导致溶液中氢氧根离子浓度减小,所以溶液的pH值变小。
本题难度:一般
5、填空题 在温度为830 K时,下列可逆反应及其平衡具有某些特殊性,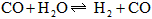 若起始浓度
若起始浓度
[CO]为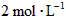 、[
、[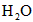 ]为
]为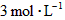 ,反应达平衡时,
,反应达平衡时,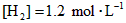 ;如果[CO]不变而将
;如果[CO]不变而将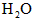 的起始浓度加大到
的起始浓度加大到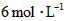 。则平衡时
。则平衡时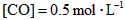 。
。
请注意上述有关数据,总结出其中的规律,根据此规律,填写以下空白:
设830 K时,起始浓度[CO]为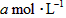 ,[
,[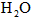 ]为
]为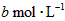 ,反应达平衡时[
,反应达平衡时[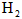 ]为
]为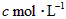
(1)当b不变,a减小,重新达平衡时,CO的转化率________,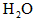 的转化率________(均填“提高”、“降低”或“不变”)
的转化率________(均填“提高”、“降低”或“不变”)
(2)当a=5,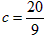 时,b=________;
时,b=________;
(3)当a=b时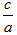 =________;
=________;
(4)当b=4,c=2时,a= _________;
(5)用以表示a、b、c之间关系的代数式为:_________。
参考答案:(1)提高;降低
(2)4
(3)0.5
(4)“略”
(5)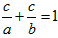 (或
(或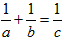 或
或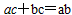 )
)
本题解析:
本题难度:一般