时间:2019-03-14 23:01:55
1、选择题 室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25 ℃其溶度积为2.8×10-9 mol2/L2,下列说法不正确的是
A.x数值为2×10-5
B.c点时有碳酸钙沉淀生成
C.加入蒸馏水可使溶液由d点变到a点
D.b点与d点对应的溶度积相等
参考答案:C
本题解析:A、根据溶度积计算x=2.8×10-9/1.4×10-4=2×10-5,正确,不选A;B、c点离子浓度乘积大于溶度积,所以有碳酸钙沉淀生成,正确,不选B;C、加入蒸馏水,溶度积不变,所以变化沿曲线移动,选C;D、温度没有改变,溶度积不变,正确,不选D。
考点:难溶电解质的溶度积常数
本题难度:一般
2、填空题 硫酸盐在生产生活中有广泛应用。
Ⅰ.工业上以重晶石(主要成分BaSO4)为原料制备BaCl2,其工艺流程示意图如下: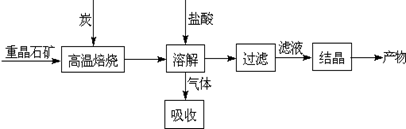
某研究小组查阅资料得:
BaSO4(s)+4C(s) 4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1 ②
2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1 ②
(1)用过量NaOH溶液吸收气体,得到硫化钠。该反应的离子方程式是 。
(2)反应C(s)+CO2(g) 2CO(g)的△H= 。
2CO(g)的△H= 。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的有两个
①从原料角度看, ;
②从能量角度看,①②为吸热反应,炭和氧气反应放热维持反应所需高温。
(4)该小组同学想对BaSO4在水中的沉淀溶解平衡做进一步研究,查资料发现在某温度时BaSO4在水中的沉淀溶解平衡曲线如图所示。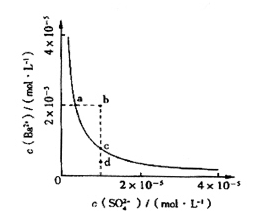
该小组同学提出以下四种观点:
①当向含有SO42-的溶液中加入Ba2+ 使SO42-沉淀完全,则此时SO42-在溶液中的浓度为0
②加入Na2SO4可以使溶液由a点变到b点
③通过蒸发可以使溶液由d点变到c点
④d点无BaSO4沉淀生成
其中正确的是 (填序号)。
Ⅱ.某燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2
参考答案:
本题解析:
本题难度:困难
3、选择题 (2011·焦作市高二期末)在下列溶液中,BaSO4的溶解度最大的是( )
A.1 mol/L H2SO4溶液
B.2 mol/L Na2SO4溶液
C.0.1 mol/L BaCl2溶液
D.纯水
参考答案:D
本题解析:固体BaSO4存在溶解平衡,BaSO4(s)? ?Ba2+(aq)+SO42-(aq),H2SO4溶液、Na2SO4溶液、BaCl2溶液均能使溶解平衡向左移动,从而降低BaSO4的溶解度,故在纯水中BaSO4的溶解度最大,D正确。
?Ba2+(aq)+SO42-(aq),H2SO4溶液、Na2SO4溶液、BaCl2溶液均能使溶解平衡向左移动,从而降低BaSO4的溶解度,故在纯水中BaSO4的溶解度最大,D正确。
本题难度:一般
4、选择题 向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀上滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是
A.白色沉淀为ZnS,而黑色沉淀为CuS
B.利用该原理可实现一种沉淀转化为更难溶的沉淀
C.该过程破坏了ZnS的溶解平衡
D.上述现象说明ZnS的Ksp小于CuS的Ksp
参考答案:D
本题解析:A.首先生成的白色沉淀是ZnS,但是仍然有很小溶解,S2-离子接着和Cu2+反应生成CuS黑色沉淀,正确;B.利用该原理可实现一种沉淀转化为更难溶的另一种沉淀,正确;C.沉淀转化的本质是平衡的移动,所以上述过程破坏了ZnS的溶解平衡,正确;D.白色沉淀ZnS转化成CuS黑色沉淀,说明CuS溶解度小于ZnS,即CuS的Ksp小于ZnS的Ksp,错误;选D。
考点:考查沉淀转化的实质。
本题难度:一般
5、选择题 在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH—(aq)。当温度不变时向此悬浊液中加入少量生石灰,此时下列说法正确的是
Ca2+(aq)+2OH—(aq)。当温度不变时向此悬浊液中加入少量生石灰,此时下列说法正确的是
A. (Ca2+)增大
(Ca2+)增大
B. (Ca2+)不变
(Ca2+)不变
C. (OH—)增大
(OH—)增大
D. (OH—)减小
(OH—)减小
参考答案:D
本题解析:题目中Ca(OH)2溶液是饱和溶液,加入生石灰发生:CaO+H2O=Ca(OH)2,减少水的量,使溶质析出,n(Ca2+)、n(OH-)减少,剩下的溶液仍然是饱和溶液,c(Ca2+)、c(OH-)不变,选项D正确。
考点:考查难容电解质的溶解平衡。
本题难度:一般