时间:2019-03-14 23:00:55
1、填空题 (10分)工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1:? ▲?。
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为? ▲?。
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL? 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为?▲?;
②若V=35,试计算混合物中CuS的质量分数。
参考答案:(1)4.6(3分)
(2)16.7%(1/6)(3分)
(3)①25<V<50(2分)?②60%(2分)
本题解析:略
本题难度:一般
2、选择题 下列有关气体制备的实验,其中装置和药品选用不正确的是?(?)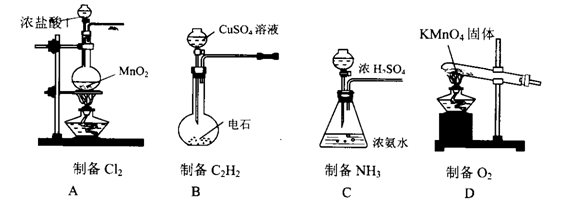
参考答案:C
本题解析:
答案:C
A、装置应选用分液漏斗、药品选用正确;B、装置正确,药品选用饱和食盐水;C、应选用分液漏斗,试剂应选用固体NaOH;D、装置不正确,试管口应放一团棉花。
本题难度:一般
3、实验题 为探究SO2与可溶性钡盐能否反应生成白色BaSO3沉淀,甲、乙两同学用下图所示装置进行实验(夹持装置、加热装置已略,气密性已检验)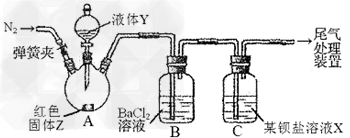
实验操作和现象
(1)A中反应的化学方程式是_________________?。?
(2)C中可溶性钡盐溶液X为_________?。实验过程中,发现液体Y不能很顺利地滴下,则可如何改进:_________。
(3)分析B中不溶于稀盐酸的沉淀的产生原因,甲同学认为是_________,乙同学认为是白雾参与反应。为证实各自的观点,在原实验基础上;甲同学在原有操作之前,先通N2一段时间。乙同学则在A、B间增加盛有饱和NaHSO3溶液的洗气瓶D。 甲、乙各自进行实验,B中现象分别如下表:由此得出的结论是_________。 
(4)丙将甲乙两同学的方案进行联合试验,发现B中无沉淀生成,而C中产生白色沉淀,但无红棕色气体。C中反应的化学方程式是________________。
(5)丁同学认为丙选择的两种钡盐比较相似,于是丁在丙的基础上将B、C中的钡盐分别换成过量新制的醋酸钡溶液、Ba(AlO2)2溶液,发现B、C中均立即产生大量白色沉淀,该沉淀可溶于稀盐酸,并产生能使澄清石灰水浑浊的气体。C中沉淀为________。实验室里欲获得该沉淀,所需要的玻璃仪器是________________。
(6)结合实验目的,根据四位同学的实验操作和实验现象,你得出的结论是________________________。
参考答案:(1)Cu+2H2SO4 CuSO4+2SO2↑+2H2O
CuSO4+2SO2↑+2H2O
(2)硝酸钡;将分液漏斗改为恒压漏斗(答案合理即可)
(3)空气参与了反应;空气、白雾均是产生白色沉淀的原因,其中白雾是主要原因
(4)3SO2+?2H2O+?3Ba(NO3)2==3BaSO4↓+2NO↑+?4HNO3
(5)BaSO3、氢氧化铝;烧杯、漏斗、玻璃棒
(6)SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀,SO2与可溶性钡的弱酸盐能反应生成BaSO3沉淀
本题解析:
本题难度:一般
4、实验题 某课外小组对一些金属单质和化合物的性质进行研究。下表为“铝与氯化铜溶液反应”实验报告的一部分:
| ? | 实验步骤 | 实验现象 |
| Ⅰ | 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。充分反应后,过滤。 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
| Ⅱ | 滤液中加入少量的NaOH溶液。 | 有白色沉淀产生。 |
| Ⅲ | 将所得红色固体用蒸馏水洗涤后,加热烘干。 | 少量红色固体变黑 |
参考答案:
本题解析:略
本题难度:简单
5、选择题 某中学学习小组在帮助老师整理实验室的化学试剂时,发现一盛有白色固体的试剂瓶,标签破损(如图),某同学为检测出其中的成分,分别进行了如下实验:
①取少量白色固体溶于水配成溶液
②取部分试液加入盐酸,产生有刺激性气味的气体,无其他明显现象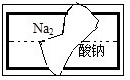
③取部分试液,滴加酸性高锰酸钾溶液,紫红色褪去酸钠
④取部分试液,加入盐酸酸化的氯化钡溶液,有白色沉淀
⑤用铂丝蘸取溶液,在酒精灯上灼烧,火焰呈黄色
该同学最终确定,这是一瓶部分被氧化的亚硫酸钠
请分析,该同学只需要完成上述哪几个实验,即可得出此结论( )
A.①②③
B.①②④⑤
C.①②④
D.①②③④
参考答案:对比选项,都有①②步骤,
②取部分试液加入盐酸,产生有刺激性气味的气体,该气体为SO2,说明含有Na2SO3,则无需③操作再重复实验验证,
④取部分试液,加入盐酸酸化的氯化钡溶液,有白色沉淀,生成的沉淀为BaSO4,说明含有Na2SO4,
由标签可知含有Na元素,则无需实验⑤证明,
最终确定,这是一瓶部分被氧化的亚硫酸钠,仅做①②④实验即可,
故选C.
本题解析:
本题难度:简单