时间:2019-03-14 23:00:55
1、选择题 向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
参考答案:A.浓硫酸具有脱水性和强氧化性,生成乙烯的同时可生成二氧化硫气体,也可使酸性高锰酸钾溶液褪色,故A错误;
B.呈紫色说明有I2生成,说明I-被氯水氧化,故B正确;
C.NaHCO3比Na2CO3溶解度小,向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊,可说明生成NaHCO3,故C正确;
D.氨气易溶于水,加入稀NaOH溶液,难以挥发出氨气,应用浓NaOH溶液或加热才可生成氨气,故D错误.
故选BC.
本题解析:
本题难度:一般
2、选择题 铜是人类认识并应用最早的金属之一,我国是最早使用铜器的国家之一。铁与人类生活密切相关,几乎无处不在,是地壳中含量仅次于铝的金属。某研究性学习小组为了证明铁的金属活动性比铜强,设计了如下实验方案:
(1)将铁片置于硫酸铜溶液中有铜析出;
(2)铁、铜和氯气反应分别生成FeCl3和CuCl2;
(3)足量的铁粉和铜粉与浓硫酸在加热条件下反应分别生成FeSO4和CuSO4;
(4)将铜片置于FeCl3溶液中铜片逐渐溶解;
(5)把铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接,铁片上无气泡产生,而铜片上有气泡产生;
?(6)把铁片和铜片置于有盛有浓硝酸的烧杯中,并用导线连接,铁片有气泡产生,而铜片上无气泡产生。
以上实验方案设计合理的有
[? ]
A.两种方案
B.三种方案
C.四种方案
D.五种方案
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列装置能达到实验目的是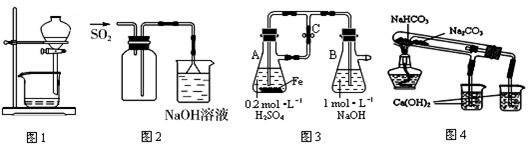
A.图1用于放出碘的四氯化碳溶液
B.图2用于实验室收集SO2
C.图3用于实验室制备Fe(OH)2
D.图4用于比较NaHCO3和Na2CO3热稳定性
参考答案:AC
本题解析:A、正确;B、密度比空气大,应长管进,短管排除空气(向上排空气法),错误;C、打开止水夹C,反应产生的氢气排尽装置中空气,关闭止水夹后A中产生的氢气把反应生成的硫酸亚铁溶液压入B中与氢氧化钠反应生成氢氧化亚铁,正确;D、内管装碳酸氢钠,外管装碳酸钠,外管温度高,错误。
本题难度:一般
4、实验题 (14分)某研究小组对铁生锈进行研究: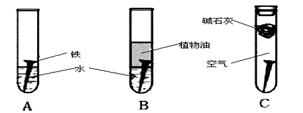
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是?(填字母),铁锈的主要成分是?
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为?
(3)铁生锈的外部条件是??;在此条件下,铁钉发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为?
(4)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是?
A. 锡? B. 铜? C. 锌?
(5)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下: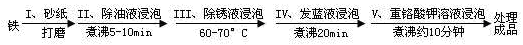
①步骤Ⅲ用除锈液(15%的硫酸溶液)浸泡铁件的目的在于除去铁表面的铁锈,该步反应的离子方程式为___________________________________。
②为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
③除锈后的铁件在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应:
反应一:____Fe +____NaNO2 +___NaOH —____Na2FeO2 +____H2O +___NH3↑
反应二:8Fe+3NaNO3 + 5NaOH + 2H2O = 4Na2Fe2O4 + 3 NH3↑
反应三:Na2FeO2 + Na2Fe2O4 + 2H2O = Fe3O4 + 4NaOH
配平“反应一”的化学方程式(将系数直接填在横线上)。若要循环使用发蓝液,从理论角度分析,需要往使用过的发蓝液中_________
A. 只需加入NaNO2? B. 只需加入NaNO2和NaNO3
C. 需要加入NaNO2、NaNO3和NaOH? D. 不需加入任何物质而直接使用
参考答案:(14分)(1)A,? Fe2O3(或 Fe2O3· xH2O)
(2)O2+2 H2O+4e-= 4 OH-
(3)潮湿的空气(或氧气与水);? 2Fe +O2 +2 H2O=2 Fe(OH)2
(4)C?(5)① Fe2O3+6 H+=2 Fe3++3 H2O
②铁制品表面有红色固体析出③ 3、1、5、3、1、1;B
本题解析:(1)B、C都不能隔绝空气,防止铁发生电化学腐蚀,而A不能,所以最容易倍腐蚀的是A。铁锈的主要成分是Fe2O3(或 Fe2O3· xH2O)。
(2)在铁的电化学腐蚀中,铁作负极,由于溶液的酸性很弱,所以正极是氧气得到电子,即反应式为O2+2 H2O+4e-= 4 OH-。
(3)铁要腐蚀电化学腐蚀,则必须处在潮湿的空气(或氧气与水),反应的总反应式是2Fe +O2 +2 H2O=2 Fe(OH)2.
(4)由于镀层一旦败损之后容易腐蚀电化学腐蚀,所以作镀金属性比铁强的金属,所以答案选C。
(5)①铁锈的主要成分是氧化铁,和稀硫酸反应的方程式为Fe2O3+6 H+=2 Fe3++3 H2O。
②因为铁的活泼性强于铜,铁能和硫酸铜反应置换出铜,所以铁制品表面有红色固体析出。
③在反应中铁失去电子作还原剂,化合价从0价升高到+2价。氧化剂是亚硝酸钠,氮元素的化合价从+3价降低到-3价,变化6个单位,即氧化剂和还原剂的物质的量之比是1︰3的,所以方程式为3Fe +NaNO2 +5NaOH=3Na2FeO2 +H2O +NH3↑。将3个反应合并即得到12Fe+NaNO3+4NaNO2+10H2O=4Fe3O4+5NH3↑+5NaOH,这说明反应中消耗的是硝酸钠和亚硝酸钠,所以需要补充二者,答案选B。
本题难度:一般
5、简答题 某种牙膏中的摩擦剂是碳酸钙,可以用石灰石(含杂质SiO2)来制备.某同学甲设计了一种制备碳酸钙的方案,其流程图为: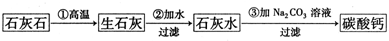
请回答下列问题:
(1)假设第①步反应完全进行,则第②步反应过滤后得到的滤渣的成分为______.
(2)第③步反应不使用CO2,其主要原因是(用离子方程式表示)______
______.
(3)第③步反应使用Na2CO3而不使用NaHCO3,从提高企业经济效益的角度考虑,其原因是______.
(4)某同学乙用石灰石为原料(其他试剂自选),设计了另一种制备碳酸钙的实验方案,请你完成他的实验方案.
乙同学所设计的方案的优点是______.
参考答案:(1)石灰石(含杂质SiO2),依据流程图分析可知,石灰石高温分解生成氧化钙和二氧化碳,氧化钙和二氧化硅反应生成硅酸钙,溶于水氧化钙和水反应生成氢氧化钙,硅酸钙不溶,过滤得到硅酸钙,滤渣是CaSiO3;
故答案为:CaSiO3;
(2)第③步反应不使用CO2,是因为二氧化碳和氢氧化钙反应生成碳酸钙,但二氧化碳过量会减小反应生成碳酸氢钙溶于水,反应的离子方程式为:Ca2+++CO2=CaCO3↓+H2O,CaCO3+CO2+H2O═Ca2++2HCO3-;
故答案为:Ca2+++CO2=CaCO3↓+H2O,CaCO3+CO2+H2O═Ca2++2HCO3-;?
(3)第③步反应使用Na2CO3而不使用NaHCO3,是因为生成等质量的CaCO3消耗NaHCO3多于Na2CO3,使用Na2CO3可制取副产品NaOH;
故答案为:生成等质量的CaCO3消耗NaHCO3多于Na2CO3;使用Na2CO3可制取副产品NaOH;
(4)①利用碳酸钙和盐酸反应生成氯化钙溶液,在溶液中加入碳酸钠溶液生成碳酸钙沉淀,过滤得到固体,
故答案为:稀盐酸;?CaCl2,Na2CO3;
②流程设计的优点是操作简单,无污染,节约原料;
故答案为:节约燃料,减小污染,操作简便;
本题解析:
本题难度:一般