时间:2018-03-17 07:48:43
1、填空题 制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下: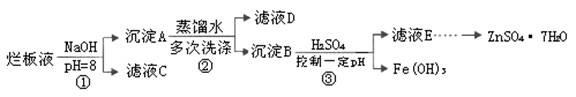
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式 。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是 (填选项)。
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是: 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
②H2O(l)  H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
请写出Fe3+发生水解反应的热化学方程式: 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K= 。(用含KSP、KW的代数式表示)
2、选择题 已知N≡N键的键能是945kJ
3、选择题 17.已知:CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH=-Q1 kJ/mol;
2H2(g)+O2(g) == 2H2O(g) ΔH=-Q2 kJ/mol;
H2O(g) == H2O(l) ΔH=-Q3 kJ/mol
常温下取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为
A.4Q1+0.5Q2
B.4Q1+Q2+10Q3
C.4Q1+2Q2
D.4Q1+0.5Q2+9Q3
4、简答题 如图1所示是工业生产硝酸的流程: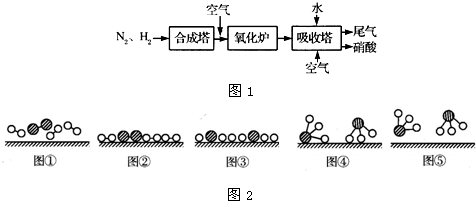
合成塔中内置铁触媒,氧化炉中内置Pt-Rh合金网.请回答下列问题:
(1)1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如图2所示.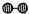
、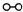
、
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______.
(2)合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g),写出该反应的化学平衡常数表达式K=______.在一定温度和压强下,将H2 和N2 按3:1(体积之比)混合后进入合成塔,反应达到平衡时,平衡混合气中NH3 的体积分数为15%,此时H2 的转化率为______.
(3)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1?266.8kJ/mol
N2(g)+O2(g)=2NO(g)△H=+1?80.5kJ/mol,氨催化氧化的热化学方程式为______.
(4)吸收塔中通入空气的目的是______.
5、填空题 4gCH4在氧气中燃烧生成CO2和液态水,放出222.5kJ热量.写出CH4燃烧的热化学方程式:______.