时间:2018-03-17 06:25:28
1、填空题 向两支分别盛有0.1mol/L醋酸和饱和硼酸(H3BO3)溶液的试管中滴加等浓度碳酸钠溶液,实验现象为(1)?三种酸由强到弱的顺序是(用化学式表示)(2)?,]硼酸(H3BO3)在食品、医药领域应用广泛。
(3) 请完成B2H6气体与水反应的化学方程式:B2H6 +6H2O=2H3BO3 +________。
(4) 在其他条件相同时,反应H3BO3 +3CH3OH  ?B(OCH3)3 +3H2O中,H3BO3的转化率(
?B(OCH3)3 +3H2O中,H3BO3的转化率(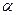 )在不同温度下随反应时间(t)的变化见下图,由此图可得出:
)在不同温度下随反应时间(t)的变化见下图,由此图可得出: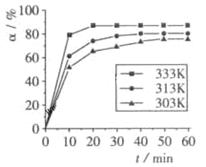
①温度对应该反应的反应速率和平衡移动的影响是____?___
②该反应的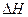 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”).
(5) H3BO 3溶液中存在如下反应: H3BO 3(aq)+H2O(l) [B(OH)4]-( aq)+H+(aq)
[B(OH)4]-( aq)+H+(aq)
已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)="2." 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,此温度下该反应的平衡常数K=?,
(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
参考答案:
(4) ①温度升高,H3BO 3的转化率增大,故升高温度是平衡正向移动,正反应是吸热反应
②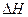 >0
>0
( 5) K=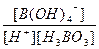 =
=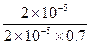 =
=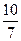 或1.43
或1.43
本题解析:略
本题难度:一般
2、选择题 H2S的水溶液中存在平衡:H2S 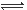 HS-+ H+和HS-
HS-+ H+和HS-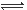 S2-+H+,当增大溶液的pH时, c(S2-)怎样变化
S2-+H+,当增大溶液的pH时, c(S2-)怎样变化
A增大 B、减小 C、不变 D、可能增大也可能减小
参考答案:D
本题解析:当增大溶液的pH的方法有多种,当通过加入碱来增大溶液的pH时,平衡向正向移动,c(S2-)会增大,如果稀释溶液,酸性会减弱,碱性增强,pH增大,此时c(S2-)减小,故c(S2-) 可能增大也可能减小,选D。
考点:电离平衡的移动的影响因素和溶液的pH变化。
本题难度:一般
3、选择题 H2S溶液中,在采取措施使pH增大的同时,则c(S2-)的变化情况是
A.增大
B.减小
C.不变
D.可能增大,也可能减小
参考答案:D
本题解析:降温,平衡逆向移动,PH增大,c(S2-)减小,加碱,则pH增大,c(S2-)也增大。选D。
本题难度:一般
4、填空题 25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
A___________________________________________________;
B____________________________________________________;
C___________________________________________________。
(2)溶液中共有______________种不同的粒子。
(3)在这些粒子中,浓度为0.01mol/L的是 ;浓度为0.002mol/L的是 。
(4) 和 两种粒子物质的量之和等于0.01mol。
参考答案:H2O H++OH-、CH3COOH
H++OH-、CH3COOH CH3COO-+H+、CH3COO-+H2O
CH3COO-+H+、CH3COO-+H2O CH3COOH+OH-(各1分,顺序可以颠倒)
CH3COOH+OH-(各1分,顺序可以颠倒)
(2)7(1分) (3)Na+(1分)Cl-(1分) (4)CH3COOH、CH3COO-(2分,顺序可以颠倒)
本题解析:(1)醋酸是弱酸,盐酸是强酸,二者混合后反应生成醋酸和氯化钠,因此存在醋酸的电离平衡。又因为醋酸钠是过量的,所以还存在醋酸根离子的水解平衡。任何水溶液中都存在水的电离平衡,有关反应的方程式分别为H2O H++OH-、CH3COOH
H++OH-、CH3COOH CH3COO-+H+、CH3COO-+H2O
CH3COO-+H+、CH3COO-+H2O CH3COOH+OH-。
CH3COOH+OH-。
(2)根据以上方程式可知,溶液中含有水分子、醋酸分子、氢离子、氢氧根离子、醋酸根离子、氯离子、钠离子,共7种微粒。
(3)已知0.01molCH3COONa,则根据离子守恒可知,浓度为0.01mol?L-1的是Na+,由0.002molHCl可知,浓度为0.002mol?L-1的是Cl-。
(4)已知0.01molCH3COONa,则根据原子守恒可知CH3COOH、CH3COO-微粒之和为0.01mol。
考点:考查离子方程式的书写;物质的量浓度的相关计算;弱电解质在水溶液中的电离平衡
本题难度:一般
5、选择题 室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表: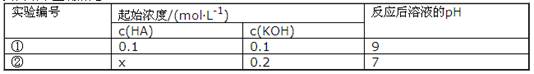
下列判断不正确的是(?)
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后溶液中:c(OH-)=c(K+)-c(A-)=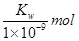 ·L-1
·L-1
C.实验②反应后的溶液中:c(A-)+c(HA)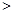 0.1mol·L-l
0.1mol·L-l
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
参考答案:B
本题解析:根据表中①的数据说明HA为弱酸,由此说明表中②的X>0.2;实验①反应后恰好生成KA,少量A-发生水解,则该溶液中c(K+)>c(A-)>c(OH-)>c(H+),A项正确;据电荷守恒在该溶液中各离子浓度的关系式为c(K+)+c(H+)=c(A-)+c(OH-),则c(OH-)=c(K+)+c(H+)-c(A-),B项错误;实验②反应后的溶液中除了有KA,还有过量的HA,再据电荷守恒得:c(K+)=c(A-)>c(OH-)=c(H+),D项正确;由于X>0.2,当一元酸HA的溶液和KOH溶液等体积混合,据物料守恒得c(A-)+c(HA)>0.1mol·L-l,C项正确。
本题难度:一般