时间:2018-03-17 06:25:28
1、选择题 常温时,下列关于电解质溶液的叙述正确的是?(?)
A.稀释pH=10的氨水,溶液中所有离子的浓度均降低
B.相同体积、相同浓度的盐酸与醋酸溶液,分别与同浓度的氢氧化钠溶液恰好完全反应时,醋酸消耗的氢氧化钠溶液体积多
C.pH=11的NaOH溶液和pH=11的氨水分别稀释100倍后的pH前者一定小于后者
D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多
参考答案:C
本题解析:A 错,加水稀释溶液,并不是所有离子浓度都降低,加水稀释氨水,c(H+)增大
B 错盐酸与醋酸的物质的量相等,消耗NaOH的物质的量也相等,所以消耗NaOH的体积相同
C 对NaOH是强碱,稀释100倍后,PH=9,氨水是弱碱,存在电离平衡,加水稀释,平衡右移,c(OH-)应大于NaOH溶液中的c(OH-),pH>9
D 错pH与体积均相同的硫酸和醋酸,醋酸消耗氢氧化钠的物质的量多
本题难度:简单
2、选择题 下列溶液中各微粒的浓度关系不正确的是( )
A.0.1mol/LCH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L
B.NaHCO3溶液中:c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+(OH-)
C.CH3COONa溶液中:c(Na+)>c(CH3COO-)>(OH-)>c(H+)
D.Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S)
参考答案:A、CH3COOH溶液中根据醋酸根守恒可知,c(CH3COO-)+c(CH3COOH)=0.1mol/L,故A正确;
B、NaHCO3溶液不显电性,所以阳离子带的正电荷总数等于阴离子带的负电荷总数,则c(H+)+c(Na+)=2c(CO32-)+
c(HCO3-)+(OH-),故B正确;
C、CH3COONa溶液中,CH3COONa═CH3COO-+Na+,因醋酸根离子水解显碱性,则c(Na+)>c(CH3COO-)、(OH-)>c(H+),水解的程度不大,则c(CH3COO-)>(OH-),故C正确;
D、Na2S溶液,n(Na)=2n(S),由物料守恒可知,12c(Na+)=c(S2-)+c(HS-)+c(H2S),故D错误;
故选D.
本题解析:
本题难度:一般
3、选择题 可以判定某酸(HA)是强电解质的事实是( )
A.该酸加热至沸腾不分解
B.0.01 mol·L-1该酸的pH=2
C.该酸可以溶解Cu(OH) 2
D.该酸与CaCO3反应放出CO2
参考答案:B
本题解析:强电解质完全电离,不存在电离平衡,B中氢离子浓度和该一元酸的浓度相等,说明完全电离,不存在电离平衡,所以选项B正确;A是酸的稳定性,C和D都是表现酸性,但并能确定是否是强电解质,答案选B。
点评:弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在,就证明了弱电解质。
本题难度:简单
4、选择题 25℃时,有关弱酸的电离平衡常数如下:下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 电离平衡常数(25℃) 1.8×10-5 4.9×10-10 K1=4.3×10-7K2=5.6×10-11 |
参考答案:A、根据电离平衡常数可知酸性强弱顺序为:CH3COOH>HCN>HCO3-,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,物质的量浓度的各溶液pH关系为:
pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故A错误;
B、如c(Na+)>c(CN-),根据溶液电中性可知c(H+)<c(OH-),溶液呈碱性,a<b或a═b都符合,故B错误;
C、冰醋酸属于弱电解质,加水促进电离,冰醋酸中逐滴加水,溶液的导电性先增大后减小,pH先减小后增大,醋酸的电离程度逐渐增大,故C错误;
D、Na2CO3和NaHCO3等物质的量混合溶液中,存在的阳离子有Na+、H+,阴离子有OH-、HCO3-、CO32-,根据溶液电中性,存在C(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确;
故选D.
本题解析:
本题难度:简单
5、选择题 pH=2的A.B两种酸溶液各lmL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是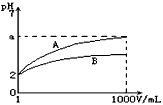
[? ]
A.A.B两种酸溶液物质的量浓度一定相等
B.稀释后A酸溶液的酸性比B酸溶液强
C.a=5时,A是强酸,B是弱酸
D.若A.B都是弱酸,则5≥a>2
参考答案:C
本题解析:
本题难度:一般