时间:2018-03-17 06:14:56
1、选择题 下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.0.2 mol/L CH3COONa溶液和0.1 mol/L HCl溶液等体积混合后:c(CH3COO-)>c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.pH=3的盐酸和NaNO3的混合溶液中:c(Na+)=c(Cl-)
C.0.1 mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
D.物质的量浓度相等的HCN(弱酸)和NaCN溶液等体积混合后有:c(HCN)+2c(H+)=2c(OH-)+c(CN-)
参考答案:D
本题解析:A项,应为c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-);B项,只给了盐酸的浓度,NaNO3的浓度未知,故不能确定c(Na+)与c(Cl-)的大小关系;C项,为电荷守恒关系,应为c(Na+)+c(H+)=c(HCO3-))+2×c(CO32-))+c(OH-)。D项,由物料守恒可得2c(Na+)=c(CN-)+c(HCN),由电荷守恒可得c(Na+)+c(H+)=c(OH-)+c(CN-),两式合并消去c(Na+)可得c(HCN)+2c(H+)=2c(OH-)+c(CN-)。
本题难度:一般
2、简答题 对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.若25℃时有HA?H++A-,则该弱酸的电离平衡常数的表达式为K=______.下表是几种常见弱酸的电离平衡常数(25℃).
| 酸 | 电离方程式 | 电离平衡常数K CH3COOH CH3COOH?CH3COOH-+H+ 1.76×10-5 H2CO3 H2CO3?H++HCO3- HCO3-?H++HCO32- K1=4.31×10-7 K2=5.61×10-11 H2S H2S?H++HS- HS-?H++S2- K1=9.1×10-8 K2=1.1×10-12 H3PO4 H3PO4?H++H2PO4- H2PO4-H++HPO42- HPO42-?H++PO43- K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
参考答案:K=C(A-).C(H+)C(HA),故答案为:K=C(A-).C(H+)C(HA);
(1)弱电解质的电离是吸热反应,升高温度促进弱电解质电离,则生成物浓度增大反应物浓度减小,所以K值增大,故答案为:增大;
(2)K值越大,酸的电离程度越大,则溶液中氢原子浓度比氢氧根离子浓度更大,所以溶液的酸性越强,故答案为:K值越大,电离出的氢离子浓度越大,所以酸性越强;
(3)电离平衡常数越大的酸性越强,越小的酸性越弱,根据表格知,酸性增强的是H3PO4,最弱的是?HPO42-,故答案为:H3PO4;HPO42-;
(4)多元弱酸分步电离,第一步电离程度最大,第二步、第三步依次减小,原因是上一级电离产生的H+对下一级电离有抑制作用,故答案为:上一级电离产生的H+对下一级电离有抑制作用.
本题解析:
本题难度:一般
3、选择题 在同体积同浓度的H2SO4、HCl、HNO3、CH3COOH溶液中,分别加入足量的Zn,下列说法中正确的是?(?)
A.硫酸中放出氢气量最多
B.醋酸中放出氢气量最多
C.盐酸中放出的氢气量最多
D.盐酸和硝酸中放出的氢气相等
参考答案:A
本题解析:在同体积同浓度的H2SO4、HCl、HNO3、CH3COOH溶液中,HNO3与Zn反应不放氢气,硫酸属于二元强酸,放氢气最多,HCl和CH3COOH放氢气一样多。答案选A。
点评:化学反应看总量,不看电离出来的离子的多少。
本题难度:一般
4、选择题 已知下面三个数据:①7.2×10-4②2.6×10-4③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2==HCN+NaNO2 NaNO2+HF==HCN+NaF? NaNO2+HF==HNO2+NaF
由此可判断下列叙述中正确的是
[? ]
参考答案:A
本题解析:
本题难度:一般
5、填空题 已知金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH。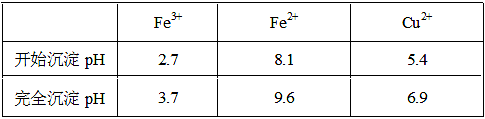
(1)实验室配制FeCl2溶液时需加入少许盐酸和铁粉,若只加盐酸、不加铁粉,溶液中会发生什么变化,用离子方程式表示为:?;
(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。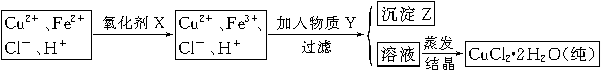
①加氧化剂X的目的是?,下列氧化剂中最适合作氧化剂X的是?(填序号);
A.NaClO
B.H2O2
C.KMnO4
D.HNO3
②物质Y的化学式是?;加入物质Y的目的是调节溶液的pH至a,使Fe3+沉淀完全,则a的范围是?;若25℃时,a=3的溶液中,c(Fe3+)=?mol·L-1。(25℃时,Ksp[Fe(OH)3]=4.0×10-38)
(3)欲将CuCl2·2H2O加热制得无水CuCl2,将采用什么方法和措施?__________。
参考答案:(1)4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
(2)①将Fe2+氧化为Fe3+?B?②CuO[或Cu(OH)2或CuCO3] 3.7≤a<5.4? 4.0×10-5
(3)在HCl气氛下蒸发,以抑制CuCl2水解
本题解析:(1)实验室配制FeCl2溶液时需加入少许盐酸和铁粉,目的是为了防止亚铁离子被氧化和析出沉淀,若只加盐酸、不加铁粉,溶液的亚铁离子被氧化为铁离子,其离子方程式为:4Fe2++O2+4H+ 4Fe3++2H2O;(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,加氧化剂X的目的是将Fe2+氧化为Fe3+,最适合作氧化剂X的是H2O2,因为其氧化产物无污染,且容易除去;②物质Y是为了调节溶液的pH,并且不能引入新的杂质,或者是杂质很容易就除去了,故Y应该为CuO[或Cu(OH)2或CuCO3],右表可以看出,铁离子在pH为3.7时沉淀完全,而铜离子在5.4时才开始沉淀,故a的范围为3.7≤a<5.4;若25℃时,a=3的溶液中,则c (OH-)=10-11mol/L,c(Fe3+)=4.0×10-38/(10-11)3mol/L= 4.0×10-5 mol/L;(3)欲将CuCl2·2H2O加热制得无水CuCl2,因为其为强酸弱碱盐,所以必须在HCl气氛下蒸发,以抑制CuCl2水解。
4Fe3++2H2O;(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,加氧化剂X的目的是将Fe2+氧化为Fe3+,最适合作氧化剂X的是H2O2,因为其氧化产物无污染,且容易除去;②物质Y是为了调节溶液的pH,并且不能引入新的杂质,或者是杂质很容易就除去了,故Y应该为CuO[或Cu(OH)2或CuCO3],右表可以看出,铁离子在pH为3.7时沉淀完全,而铜离子在5.4时才开始沉淀,故a的范围为3.7≤a<5.4;若25℃时,a=3的溶液中,则c (OH-)=10-11mol/L,c(Fe3+)=4.0×10-38/(10-11)3mol/L= 4.0×10-5 mol/L;(3)欲将CuCl2·2H2O加热制得无水CuCl2,因为其为强酸弱碱盐,所以必须在HCl气氛下蒸发,以抑制CuCl2水解。
点评:本题考查了盐类水解,溶度积等知识点,这些考点都是高考考查的重点和难点,本题有一定的综合性,关键是要根据表中的数据进行解答,本题难度中等。
本题难度:一般