时间:2018-03-17 06:14:56
1、选择题 下列说法正确的是
[? ]
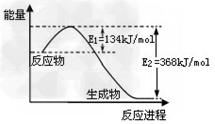
A.?已知1?mol?NO2和1?mol?CO反应生成CO2和NO过程中能量变化如图,则NO2和CO反应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g);△H=?+234kJ/mol ?
B.?一定温度下,利用pH计测定不同浓度醋酸溶液的pH 值,得到数据(如上表)
当醋酸浓度为0.1mol/L时,通过计算求得该温度下醋酸的电离度为1%
C.?已知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液的浓度为?5.6×10-5?mol/L,则生成沉淀所需Na2CO3溶液的最小浓度为?5×10-5mol/L
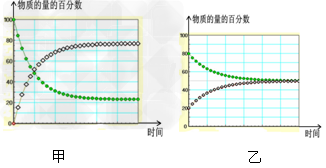
D.?在不同条件下进行的异构化反应?X Y?的进程图解。图中的“
Y?的进程图解。图中的“ ”是X,“
”是X,“ ”是Y 则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小
”是Y 则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小
参考答案:B
本题解析:
本题难度:一般
2、选择题 pH相同的醋酸和盐酸,分别用水稀释至原体积的m倍和n倍,稀释后两溶液pH仍相等,则m和n的关系是
A.m=n
B.m>n
C.m<n
D.无法比较
参考答案:B
本题解析:pH相同的CH3COOH和HCl,若稀释相同的倍数,则CH3COOH的pH小于HCl的pH(CH3COOH为弱酸,在稀释过程中CH3COOH不断电离产生H+,使H+总量不断增加,而盐酸中H+的量始终不变),所以CH3COOH必须继续加水稀释,方能使其pH与盐酸的相等。所以m>n。
本题难度:简单
3、选择题 将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法中正确的是
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法中正确的是
①用物质A 表示的反应的平均速率为0.3 mol·L-1·S-1
②用物质B 表示的反应的平均速率为0.6 mol·L-1·S-1
③2 s 时物质A 的转化率为70%
④2 s 时物质B 的浓度为0.7 mol·L-1,
A.①③
B.①④
C.②③
D.③④
参考答案:B
本题解析:由经2 s后测得C的浓度为0.6 mol·L-1,则v(C)=0.3 mol·L-1·s-1,又由同一化学反应的不同物质所表示反应速率之比与方程式中各对应物质前的系数成正比知,v(A)=0.3 mol·L-1·s-1,v(B)=0.15 mol·L-1·s-1;
2 s时物质A的转化率为α(A)=×100%=30%;
2 s时物质B的浓度为=0.7 mol·L-1。
所以①、④是正确的。
本题难度:一般
4、选择题 已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH CH3COO— + H+?K1=1.75×10-5?△H1>0
CH3COO— + H+?K1=1.75×10-5?△H1>0
CH3COO— + H2O CH3COOH + OH—?K2=5.71×10-10?△H2>0
CH3COOH + OH—?K2=5.71×10-10?△H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是
A.对混合溶液进行微热,K1增大、K2减小
B.混合溶液的pH<7
C.混合溶液中c(CH3COO—)>c(Na+)
D.温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO—)减小
参考答案:BC
本题解析:A、电离和水解均是吸热的,所以对混合溶液进行微热,K1、K2均增大,A不正确;B、由于醋酸根的水解常数小于醋酸的电离常数,因此二者浓度相同的混合液显酸性,即pH<7,B正确;C、醋酸的电离程度大于醋酸根的水解程度,溶液显酸性,则根据电荷守恒混合溶液中c(CH3COO—)+c(OH—)=c(Na+)+c(H+)可知,混合溶液中c(CH3COO—)>c(Na+),C正确;D、温度不变,若在混合溶液中加入少量NaOH固体,中和氢离子,促进醋酸的电离,所以溶液中c(CH3COO—)增大,D不正确,答案选BC。
本题难度:一般
5、填空题 (14分)下列物质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH溶液;⑤BaSO4;⑥H2O;⑦HCl;⑧H2SO4?⑨CO2;⑩酒精溶液(均填写编号回答)
⑴是弱电解质的有?,是非电解质的有?。
⑵pH相等的②的溶液和③的溶液等体积加水稀释相同倍数后,pH大的是?。
⑶有pH均为2的④、⑦、⑧三种物质的溶液,物质的量浓度大到小的顺序为?,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是?。
(4)某温度时,0.01 mol?L-1的醋酸溶液电离平衡常数为1. 0×10 -8,醋酸的电离平衡常数表达式为?,达平衡时,溶液中氢离子浓度是??,当向该溶液中加入一定量的盐酸时,电离常数?发生变化(填是、否)。
(5)将pH=1的盐酸平均分成2份,1份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入了水与NaOH溶液的体积比为?。
参考答案:⑴③⑥,⑨;⑵③;⑶?④⑦⑧,a﹤b=c。
(4) K= 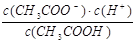 ,4.18×10 -4 mol?L-1?,否。?(5)11:1
,4.18×10 -4 mol?L-1?,否。?(5)11:1
本题解析:(1)弱电解质包括:弱酸、弱碱、水、极个别的盐;④CH3COOH溶液是混合物,故不属于弱电解质;
(2)NaOH是强碱,完全电离,NH3·H2O是弱碱,部分电离,且存在NH3·H2O的电离平衡;加水稀释相同倍数后,NH3·H2O的电离平衡正向移动,故[OH-]:NH3·H2O>NaOH,所以,pH大的是③NH3·H2O;
(3)④CH3COOH是弱酸 ⑦HCl是一元强酸 ⑧H2SO4是二元强酸,三者PH相等,即自由移动的H+浓度相等,则物质的量浓度大到小的顺序为:CH3COOH(c>0.01mol.L-1)>HCl(c=0.01mol.L-1)>H2SO4(c=0.005mol.L-1);
对HCl、H2SO4,均是:H+ + OH- = H2O?
1?1
则中和含等物质的量NaOH的溶液时,[H+]HClb=[H+]H2SO4c,因为[H+]HCl=[H+]H2SO4,所以b=c,
CH3COOH +NaOH= CH3COONa+H2O ,则c(CH3COOH)a =等物质的量NaOH,而c(CH3COOH) >[H+]HCl=[H+]H2SO4,所以a<b=c;
(4)? CH3COOH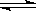 CH3COO-+H+?
CH3COO-+H+?
C0?0.01? 0? 0
△C? x? x? x
C(平衡) 0.01-x? x? x
则:x2/( 0.01-x)= 1.0×10 -8,得:[H+]=" x" =4.18×10 -4 mol?L-1?
平衡常数仅受温度影响,故加入一定量的盐酸时,电离常数不发生变化;
(5)PH由1变到2,即H+浓度由0.1mol?L-1变到0.01mol?L-1,
第一份加水:0.01mol?L-1=[0.1×V(HCl)]/[ V(HCl)+V(H2O)],得:V(H2O)=9V(HCl),
第二份加碱:0.01mol?L-1=[0.1×V(HCl)- 0.1×V(NaOH)]/[ V(HCl)+V(NaOH)],得:V(NaOH)=9/(11V),
所以:V(H2O):V(NaOH)= 11:1
本题难度:一般