时间:2018-03-17 05:54:13
1、选择题 化学反应N2+3H2 2NH3的能量变化如图所示,该反应的热化学方程式是( )
2NH3的能量变化如图所示,该反应的热化学方程式是( )
A.N2(g)+3H2(g) 2NH3(l) ΔH=2(a-b-c)kJ·mol-1
2NH3(l) ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g) 2NH3(g) ΔH=2(b-a)kJ·mol-1
2NH3(g) ΔH=2(b-a)kJ·mol-1
C.N2(g)+H2(g) NH3(l) ΔH=(b+c-a)kJ·mol-1
NH3(l) ΔH=(b+c-a)kJ·mol-1
D.N2(g)+H2(g) NH3(g) ΔH=(a+b)kJ·mol-1
NH3(g) ΔH=(a+b)kJ·mol-1
参考答案:A
本题解析:由图示可知:(1)断裂 mol N2(g)和mol H2(g)中的化学键共吸收a kJ的能量,由1 mol N和3 mol H生成1 mol NH3(g)放出b kJ的能量,由1 mol NH3(g)变为1 mol NH3(l)放出c kJ能量;(2)由mol N2(g)和mol H2(g)生成1 mol NH3(g)或1 mol NH3(l)均放出能量。故有①N2(g)+H2(g) NH3(g) ΔH=-(b-a)kJ·mol-1=(a-b)kJ·mol-1或②N2(g)+H2(g)
NH3(g) ΔH=-(b-a)kJ·mol-1=(a-b)kJ·mol-1或②N2(g)+H2(g) NH3(l) ΔH=-(b+c-a)kJ·mol-1=(a-b-c)kJ·mol-1,因此C、D项均错误。将①式乘以2得:N2(g)+3H2(g)
NH3(l) ΔH=-(b+c-a)kJ·mol-1=(a-b-c)kJ·mol-1,因此C、D项均错误。将①式乘以2得:N2(g)+3H2(g) 2NH3(g) ΔH=2(a-b)kJ·mol-1,B项错误;将②式乘以2得:N2(g)+3H2(g)
2NH3(g) ΔH=2(a-b)kJ·mol-1,B项错误;将②式乘以2得:N2(g)+3H2(g) 2NH3(l) ΔH=2(a-b-c)kJ·mol-1,A项正确。
2NH3(l) ΔH=2(a-b-c)kJ·mol-1,A项正确。
本题难度:一般
2、填空题 聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类‘“主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示)。
(1)一定条件下,向1.0 mol/LAlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_____________________。
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如下表:
| AlT/(mol·L-1) | Ala/% | Alb/% | A1c/% |
| 0.208 | 1.4 | 86.6 | 12.0 |
| 0.489 | 2.3 | 86.2 | 11.5 |
| 0.884 | 2.3 | 88.1 | 9.6 |
| 1.613 | 3.1 | 87.0 | 9.9 |
| 2.520 | 4.5 | 88.2 | 7.3 |
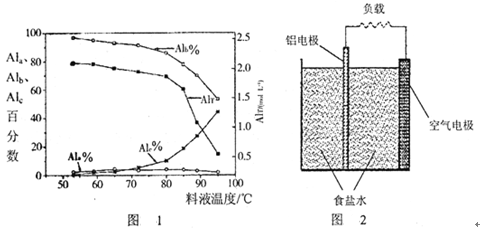
参考答案:(1)13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+;(2)①减小;②Al3++3H2O=Al(OH)3(胶体)+3H+;③温度升高,水解程度加大,产生氢氧化铝沉淀;(3)a+b;>;(4)O2+2H2O+4e-=4OH-。
本题解析:(1)根据题意结合原子守恒、电荷守恒可得生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+;(2)①在一定温度下,AlT越大,Ala%越大,Alc%越小,所以pH减小;②如将AlT =" 2.520" mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式:Al3++3H2O=Al(OH)3(胶体 www.91exAm.org)+3H+;③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图所示。当T>80℃时,AlT显著下降的原因是温度升高,水解程度加大,产生氢氧化铝沉淀;(3)①+②整理可得Al2O3(s)+ 3C(s) =" 2Al(l)+" +3CO(g) △H =△H1+△H2 =-(a+b)kJ/mol;反应①常压下在1900℃的高温下才能进行,说明该反应是吸热反应,△H>0;(4)在该铝空气电池中活动性强的Al作负极,活动性弱的C作正极。由于是在中性介质中,所以发生的是吸氧腐蚀。该电池正极的电极反应式是O2+2H2O+4e-=4OH-。
考点:考查物质的存在形式与溶液酸碱性的关系、离子方程式的书写、反应的热效应的判断、原电池反应原理的知识。
本题难度:困难
3、填空题 磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是_______________,其相应的质量(g)为______________。
(2)已知单质磷的燃烧热为YkJ/mol,则1mol P与O2反应生成固态P2O3的反应热ΔH=___________。
(3)写出1mol P与O2反应生成固态P2O3的热化学方程式:_________________。
参考答案:(1)P2O;P2O3; 2.75g;3.55g
(2)-(20X-Y)kJ·mol-1
(3)P(s)+O2(g) = P2O3(s);△H=-(20X-Y)kJ/mol
本题解析:
本题难度:一般
4、选择题 25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量。下列表示该反应的热化学方程式中正确的是
[? ]
A.CH4O(l)+3/2O2(g)= CO2(g)+2H2O(l) △H=-725.8kJ/mol
B.2CH4O(l)+3O2(g)= 2CO2(g)+4H2O(l) △H=+1451.6kJ/mol
C.2CH4O+O2 = 2CO2+4H2O(l) △H=-22.68kJ/mol
D.CH4O(l)+3/2O2(g) = CO2(g)+2H2O(g) △H=-725.8kJ/mol
参考答案:A
本题解析:
本题难度:一般
5、填空题 为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) △H=-566kJ·moL-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ·moL-1
H2O (g)=H2O(l) △H=-44.0KJ·moL-1
(1)氢气的标准燃烧热△H= kJ·moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为 ;反应达到平衡后,升高温度,此时平衡常数将 (填“变大”、“不变”或“变小”),平衡将向 (填“正”或“逆”)方向移动。
(4)在CO和H2O反应转化为绿色能源H2中,为了提高CO的转化率,可采取的措施是 。
A.增大的CO浓度
B.增大的H2O(g)浓度
C.使用催化剂
D.降低温度
参考答案:(共11分)(1)-285.8(2分)
(2)CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ/mol(3分)
(3)50%(2分);变小(1分);逆(1分) (4)BD(2分)
本题解析:(1)通常条件下,1mol氢气完全燃烧生成液态水放出的热量为氢气的燃烧热。已知反应①2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ·moL-1、②H2O (g)=H2O(l) △H=-44.0KJ·moL-1,则根据盖斯定律可知,①× +②即得到反应H2(g)+
+②即得到反应H2(g)+ O2(g)=H2O(g),所以该反应的△H=-483.6KJ?moL-1÷2+-44.0KJ·moL-1=-285.8KJ?moL-1,即氢气的标准燃烧热△H=-285.8KJ?moL-1。
O2(g)=H2O(g),所以该反应的△H=-483.6KJ?moL-1÷2+-44.0KJ·moL-1=-285.8KJ?moL-1,即氢气的标准燃烧热△H=-285.8KJ?moL-1。
(2)已知反应①2CO(g)+O2(g)=2CO2(g) △H=-566kJ·moL-1、②2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ·moL-1,则根据盖斯定律可知,(①-②)÷2即得到反应CO(g)+H2O(g)=CO2(g)+H2(g) ,所以该反应的分液△H=(-566kJ·moL-1+483.6KJ·moL-1)÷2=-41.2kJ/mol。(3)(3)令参加反应的CO的物质的量浓度为nmol/L,则:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L)1 1 0 0
转化浓度(mol/L)n n n n
平衡浓度(mol/L)1-n 1-n n n
所以根据平衡常数可知K= =
= =1
=1
解得n=0.5mol/L
所以t℃时CO的转化率为 ×100%=50%
×100%=50%
由(2)可知该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数变小。
(4)A、增大的CO浓度,平衡向正反应移动,但CO的转化率降低,故A错误;B、增大的H2O(g)浓度,平衡向正反应移动,但CO的转化率增大,故B正确;C、使用催化剂加快反应速率,平衡不移动,CO转化率不变,故C错误;D、降低温度平衡向正反应移动,但CO的转化率增大,故D正确,答案选BD。
考点:考查燃烧热计算、热化学方程式的书写;外界条件对平衡状态的影响;平衡常数的计算和应用等
本题难度:困难