时间:2018-03-17 05:54:13
1、选择题 化学反应N2+3H2 2NH3的能量变化如图所示,该反应的热化学方程式是( )
2NH3的能量变化如图所示,该反应的热化学方程式是( )
A.N2(g)+3H2(g) 2NH3(l) ΔH=2(a-b-c)kJ·mol-1
2NH3(l) ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g) 2NH3(g) ΔH=2(b-a)kJ·mol-1
2NH3(g) ΔH=2(b-a)kJ·mol-1
C.N2(g)+H2(g) NH3(l) ΔH=(b+c-a)kJ·mol-1
NH3(l) ΔH=(b+c-a)kJ·mol-1
D.N2(g)+H2(g) NH3(g) ΔH=(a+b)kJ·mol-1
NH3(g) ΔH=(a+b)kJ·mol-1
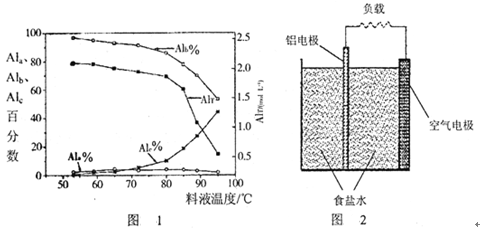
2、填空题 聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类‘“主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示)。
(1)一定条件下,向1.0 mol/LAlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_____________________。
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如下表:
| AlT/(mol·L-1) | Ala/% | Alb/% | A1c/% |
| 0.208 | 1.4 | 86.6 | 12.0 |
| 0.489 | 2.3 | 86.2 | 11.5 |
| 0.884 | 2.3 | 88.1 | 9.6 |
| 1.613 | 3.1 | 87.0 | 9.9 |
| 2.520 | 4.5 | 88.2 | 7.3 |
3、填空题 磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是_______________,其相应的质量(g)为______________。
(2)已知单质磷的燃烧热为YkJ/mol,则1mol P与O2反应生成固态P2O3的反应热ΔH=___________。
(3)写出1mol P与O2反应生成固态P2O3的热化学方程式:_________________。
4、选择题 25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量。下列表示该反应的热化学方程式中正确的是
[? ]
A.CH4O(l)+3/2O2(g)= CO2(g)+2H2O(l) △H=-725.8kJ/mol
B.2CH4O(l)+3O2(g)= 2CO2(g)+4H2O(l) △H=+1451.6kJ/mol
C.2CH4O+O2 = 2CO2+4H2O(l) △H=-22.68kJ/mol
D.CH4O(l)+3/2O2(g) = CO2(g)+2H2O(g) △H=-725.8kJ/mol
5、填空题 为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) △H=-566kJ·moL-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ·moL-1
H2O (g)=H2O(l) △H=-44.0KJ·moL-1
(1)氢气的标准燃烧热△H= kJ·moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为 ;反应达到平衡后,升高温度,此时平衡常数将 (填“变大”、“不变”或“变小”),平衡将向 (填“正”或“逆”)方向移动。
(4)在CO和H2O反应转化为绿色能源H2中,为了提高CO的转化率,可采取的措施是 。
A.增大的CO浓度
B.增大的H2O(g)浓度
C.使用催化剂
D.降低温度