时间:2017-11-11 04:21:09
1、填空题 (本题共12分)对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。汽车尾气脱硝脱碳的主要原理为:
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=
N2(g)+2CO2(g) ΔH=  Q(Q>0)。
Q(Q>0)。
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
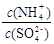 的值将 (填“变大”、“不变”或“变小”)
的值将 (填“变大”、“不变”或“变小”)参考答案:29.K=c(N2)·c(CO2) 2/c(NO)2·c(CO)2 (1分)
30.1.875×10-4 mol/(L·s) (2分)25% (2分)
31.B、D (2分) 32.变大 (1分) 33.②>①>③(2分)
34.饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀。加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生。(2分)
本题解析:29.反应2NO(g)+2CO(g) 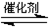 N2(g)+2CO2(g)的化学平衡常数是K=c(N2)·c(CO2) 2/c(NO)2·c(CO)2;
N2(g)+2CO2(g)的化学平衡常数是K=c(N2)·c(CO2) 2/c(NO)2·c(CO)2;
30. 在前2s内,c(NO)由1.00×10-3mol/L变为2.50×10-4mol/L,改变了7.50×10-4mol/L,则根据方程式中NO与N2的反应关系可知N2浓度是7.50×10-4mol/L÷2=3.75mol/L。则V(N2)= 3.75mol/L÷2s=1.875×10-4 mol/(L·s);达到平衡时,CO的转化率为[(3.60×10-3mol/L-2.70×10-3mol/L)÷3.60×10-3mol/L]×100%=25%;
31. A.在任何时刻都存在:υ正(NO)=2υ正(N2) 。若2υ正(NO)=υ逆(N2),则υ逆(N2)=4υ正(N2) ,用同一种物质表示的化学反应速率,正逆反应速率不等,反应没有处于平衡状态,错误; B.由于该反应是反应前后气体体积不等的质量不变的反应,若反应达到平衡状态,则气体的物质的量不变,容器中气体的平均分子量就不变,因此容器中气体的平均分子量应不随时间而变可以证明反应处于平衡状态,正确;C.由于该反应反应物和生成物都是气体,容器的容积不变,所以在任何时刻容器中气体的密度都不会发生变化,因此不能作为判断平衡的标志,错误; D.若容器中CO的物质的量发生变化,反应就没有达到平衡状态,若达到平衡状态,则CO的物质的量不变,CO的转化率不变,反应处于平衡状态,正确;
32.往(NH4)2SO4的稀溶液中再加入少量(NH4)2SO4固体,溶液的浓度增大。由于该盐是强酸弱碱盐,NH4+会发生水解反应而消耗,浓度增大,盐的水解平衡逆向移动,盐水解的程度减小,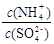 的值将变大。
的值将变大。
33.在三种盐溶液中都存在NH4+的水解作用,NH4++H2O NH3·H2O+H+;NH4+水解使溶液显酸性,在NH4HCO3溶液中除了存在NH4+水解外,还存在HCO3-的水解作用:HCO3-+H2O
NH3·H2O+H+;NH4+水解使溶液显酸性,在NH4HCO3溶液中除了存在NH4+水解外,还存在HCO3-的水解作用:HCO3-+H2O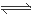 H2CO3+OH-;HCO3-水解使溶液显碱性,二者的水解的酸碱性相反,对彼此的水解起促进作用,所以水解程度增大。对于NH4HSO4来说,是强酸的酸式盐,NH4HSO4=NH4++H++SO42-。电离产生的H+对NH4+的水解平衡起抑制作用,是其水解程度减小。所以① NH4Cl、②NH4HCO3、③NH4HSO4这三种溶液中水的电离程度由大到小的顺序是②>①>③;
H2CO3+OH-;HCO3-水解使溶液显碱性,二者的水解的酸碱性相反,对彼此的水解起促进作用,所以水解程度增大。对于NH4HSO4来说,是强酸的酸式盐,NH4HSO4=NH4++H++SO42-。电离产生的H+对NH4+的水解平衡起抑制作用,是其水解程度减小。所以① NH4Cl、②NH4HCO3、③NH4HSO4这三种溶液中水的电离程度由大到小的顺序是②>①>③;
34.由于酸性HCl>H2SO3,所以向BaCl2溶液中通入足量SO2气体,只发生化合反应:SO2+H2O= H2SO3,H2SO3是弱酸,电离产生的SO32-浓度很小,没有发生复分解反应生成沉淀生成,继续滴加一定量的氨水后,氨水电离产生的OH-对H2SO3的电离平衡起促进作用,产生更多的SO32-,使c(SO32-)增大,SO32-就与溶液中的Ba2+结合生成BaSO3沉淀。
考点:考查化学平衡常数的表达式的书写、化学平衡状态的判断、盐的水解程度的大小比较及影响因素、程度平衡理论的应用、化学反应速率和物质的平衡转化率的计算的知识。
本题难度:困难
2、选择题 下列物质的水溶液,其pH小于7的是( )
A.Na2CO3
B.NH4NO3
C.Ba(OH)2
D.KNO3
参考答案:B
本题解析:
本题难度:简单
3、填空题 (14分)25℃时0.1 mol/L的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:
甲认为:醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;
乙认为:醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大.
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH.(已知25℃时,CH3COONH4溶液呈中性).
A.固体CH3COOK
B.固体CH3COONH4
C.气体NH3
D.固体NaHCO3
(2)加入(1)中物质后,若甲的解释正确,溶液的pH应________;若乙的解释正确,溶液的pH应________;(填“增大”“减小”或“不变”).
(3)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液.判断:
①溶液中共有________种粒子;
②其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________;
③溶液中n(CH3COO-)+n(OH-)-n(H+)=________mol.
参考答案:(1)B (2)不变 增大(3)①7 ②CH3COOH CH3COO-③0.006
本题解析:(1)CH3COONH4溶液中,CH3COO-和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,CH3COONH4加入到0.1 mol?L-1醋酸中使pH增大,说明CH3COO-抑制了醋酸的电离,其它物质的水溶液都呈碱性,不能用于证明,故答案为:B;(2)醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,则溶液pH增大,故答案为:增大;(3)①将0.010molCH3COONa和0.004molHCl溶于水,由于发生CH3COO-+H+?CH3COOH,溶液中存在CH3COO-、Cl-、OH-、H+、Na+、CH3COOH和H2O等粒子,共7种,故答案为:7;②根据物料守恒可知,0.010mol CH3COONa在溶液中以CH3COOH和CH3COO-存在,n(CH3COOH)+n(CH3COO-)=0.010mol,故答案为:CH3COOH;CH3COO-;③溶液遵循电荷守恒,存在:n(H+)+n(Na+)=n(Cl-)+n(CH3COO-)+n(OH-),则n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.010mol-0.004mol=0.006mol,故答案为:0.006.
考点:盐类水解的原理
本题难度:一般
4、选择题 已知:某元素X的酸式盐(NaHX)溶液显碱性,下列说法正确的是
A.NaHX的电离方程式为NaHX===Na+ + H+ + X2¯
B.HX¯的电离程度小于HX¯的水解程度
C.离子浓度关系:c(Na+) + c(H+) = c(OH¯) + c(HX¯) + c(X2¯)
D.加水稀释,促进HX¯水解,c(HX¯)增大
参考答案:B
本题解析:酸式盐(NaHX)溶液显碱性,HX-离子水解大于电离,说明H2X是弱酸,A、NaHX的电离方程式为NaHX===Na+ + HX¯,A错误;B、溶液显碱性,HX¯的电离程度小于HX¯的水解程度,B正确;C、由电荷守恒可知离子浓度关系:c(Na+) + c(H+) = c(OH¯) + c(HX¯) + 2c(X2¯),C错误;D、加水稀释,促进HX¯水解,c(HX¯)减小,不是增大,D错误;答案选B。
考点:电解质溶液
本题难度:一般
5、选择题 把物质的量浓度均为0.1mol·L-1的HA和BOH溶液等体积混合,下列说法错误的是
A.若HA为弱酸,BOH为弱碱,则有C(H+)+C(B+)===C(OH-)+ C(A-)
B.若HA为强酸,BOH为弱碱,则有C(A-)>C(B+) >C(H+) >C(OH-)
C.若HA为弱酸,BOH为强碱,则有C(B+) >C(A-) >C(OH-) >C(H+)
D.若HA为强酸,BOH为强碱,则有C(H+)= C(A-)= C(B+)= C(OH-)=0.1mol·L-1
参考答案:D
本题解析:D项:等体积混合,溶液的体积扩到了二倍,浓度缩小了二倍,故C(H+)= C(A-)= C(B+)= C(OH-)=0.05mol·L-1,故错。故选D。
考点:离子浓度大小的比较 酸碱混合时的定性判断及有关ph的计算
点评:本题考查离子浓度的大小比较,题目难度中等,解答该题的关键是根据溶液的pH和溶液中氢离子与氢氧根离子判断电解质的强弱,结合盐类水解的原理可解答该题。
本题难度:困难