时间:2017-11-11 04:21:09
1、选择题 根据右表,以下错误的是
| 酸 | HF | H3PO4 |
| 电离常数 | Ki =" 3.6×10" - 4 | Ki1=" 7.5×10" -3 Ki2=" 6.2×10" -8 Ki3=" 2.2×10" -13 |
参考答案:C
本题解析:根据表格提供的数据可知HF的电离平衡常数小于H3PO4的一级电离平衡常数,大于H3PO4的二级电离平衡常数,所以根据强酸制取弱酸的性质可知,NaF和H3PO4反应的产物只有HF、NaH2PO4,正确;B.Na3PO4 、Na2HPO4 、NaF、NaH2PO4都是强碱弱酸盐。弱酸根离子发生水解反应而消耗水电离产生的H+,是溶液显碱性。酸的电离平衡常数越小,相应的酸根离子水解程度就越大,溶液的碱性就越强,pH就越大。由于HF的电离平衡常数小于H3PO4的一级电离平衡常数,大于H3PO4的二级电离平衡常数,H3PO4的二级电离平衡常数大于H3PO4的三级电离平衡常数,所以等浓度的这几种盐溶液的pH由大到小的顺序是Na3PO4>Na2HPO4>NaF>NaH2PO4,正确;C.H3PO4是三元弱酸,电离分步进行。主要发生第一不电离。H3PO4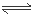 H++H2PO4-。而且第一步的电离会对第二、第三步的电离平衡起抑制作用。假设发生该步电离产生的H+的浓度是x,则K=
H++H2PO4-。而且第一步的电离会对第二、第三步的电离平衡起抑制作用。假设发生该步电离产生的H+的浓度是x,则K=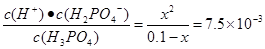 。解得x=2.74×10-2mol/L<0.1mol/L,错误;D.在两种溶液中微粒都存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(F-);c(Na+)+c(H+)=c(OH-)+c(H2PO4-);每种溶液中含有的离子都是Na+和H+浓度的2倍。在NaF和NaH2PO4溶液中都存在阴离子的水解作用。两种盐的浓度相等,所以c(Na+)相等。根据电离平衡常数可知水解程度NaF> NaH2PO4,所以溶液中的c(OH-):NaF> NaH2PO4,则根据水的离子积常数可知溶液中溶液中c(H+):NaH2PO4> NaF,所以在25℃时,等体积、等浓度的NaF和NaH2PO4溶液中所含离子总数前者小于后者,正确。
。解得x=2.74×10-2mol/L<0.1mol/L,错误;D.在两种溶液中微粒都存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(F-);c(Na+)+c(H+)=c(OH-)+c(H2PO4-);每种溶液中含有的离子都是Na+和H+浓度的2倍。在NaF和NaH2PO4溶液中都存在阴离子的水解作用。两种盐的浓度相等,所以c(Na+)相等。根据电离平衡常数可知水解程度NaF> NaH2PO4,所以溶液中的c(OH-):NaF> NaH2PO4,则根据水的离子积常数可知溶液中溶液中c(H+):NaH2PO4> NaF,所以在25℃时,等体积、等浓度的NaF和NaH2PO4溶液中所含离子总数前者小于后者,正确。
考点:考查电离平衡常数在物质发生反应的产物的确定及溶液中微粒浓度大小比较中的应用的知识。
本题难度:一般
2、选择题 用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是( )
A.c(NH4+)>c(Cl-), c(OH-)> c(H+)
B.c(NH4+)=c(Cl-), c(OH-)= c(H+)
C.c(Cl-) > c(NH4+), c(H+)> c(OH-)
D.c(Cl-) > c(NH4+), c(OH-)> c(H+)
参考答案:D
本题解析:D错,由溶液呈电中性即电荷守恒可得: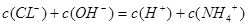 ,若c(CL—) > c(NH4+),则c(OH—)< c(H+)
,若c(CL—) > c(NH4+),则c(OH—)< c(H+)
本题难度:困难
3、选择题 下列各反应的方程式中,属于水解反应的是: ( )
参考答案:D
本题解析:考查盐的水解、水解方程式的书写
A:属于弱电解质水的电离方程式
B :属于碳酸氢盐与碱的离子反应方程式
C:属于电离方程式(两边均去一分水即可)
D:属于水解方程式,选D
本题难度:一般
4、选择题 下列说法正确的是
A.常温下,PH=7的CH3COONa和CH3COOH的混合溶液[c(Na+)=0.1mol/L]中各离子浓度关系:c(CH3COOH)>c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
B.0.1mol/LNa2CO3溶液中:c(Na+)>c(CO32-)> c(HCO3-)>c(OH-)
C.0.1mol/LNaHCO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
D.向0.2 mol/LNaHCO3溶液中加入等体积的0.1mol/LNaOH溶液:c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
参考答案:D
本题解析:A、根据电荷守恒有: c(CH3COO-)+c(OH-)=c(Na+)+c(H+)。故有c(CH3COO-)=c(Na+);
B、氢氧根来源于两级电离,故c(OH-)> c(HCO3-);
C、根据电荷守恒c(Na+)+c(H+)= 2c(CO32-)+ c(HCO3-)+c(OH-);物料守恒有:c(Na+)=c(CO32-)+ c(HCO3-)+c( H2CO3);有c(OH-)-c(H+)=c(H2CO3)- c(CO32-)
本题难度:简单
5、选择题 常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是()
A.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后混合后,溶液的pH=7,则反应后的混合后,2c(R2-)+c(HR-)=c(Na+)
B.0.05mol/L的CH3COOH溶液中加入等体积的0.05mol/L的KOH溶液,则:c(CH3COOH)+c(H+)=c(OH-)
C.pH=5的CH3COOH溶液和pH=5NH4Cl溶液中c(H+)相等
D.0.2mol/L NH4Cl和0.1mol/L NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
参考答案:D
本题解析:A.根据电荷守恒可得:2c(R2-)+c(HR-)+c(OH-)=c(H+)+c(Na+),由于溶液显中性,所以c(OH-)=c(H+),两式相减可得2c(R2-)+c(HR-)=c(Na+),正确;B. 0.05mol/L的CH3COOH溶液中加入等体积的0.05mol/L的KOH溶液,二者恰好完全反应产生盐CH3COOK.由于该盐是强酸弱碱盐,醋酸根离子发生水解反应消耗水电离产生的H+,使溶液显碱性则根据质子守恒可得:c(CH3COOH)+c(H+)=c(OH-),正确;C.由于溶液的pH 相等,所以溶液中c(H+)相等,正确;D. 0.2mol/L NH4Cl和0.1mol/L NaOH溶液等体积混合,二者会发生反应:NH4Cl+ NaOH=NaCl+NH3·H2O。根据物质的量的关系可知得到的是NaCl、NH3·H2O、NH4Cl等物质的量浓度的混合溶液。由于NH3·H2O的电离作用大于NH4+的水解作用,所以c(NH4+)>c(Cl-)>c(Na+),c(OH-)>c(H+);盐的电离作用远大于水的电离作用,所以c(Na+)>c(OH-)。因此混合后溶液中离子浓度大小关系是:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+),正确。
考点:考查溶液中离子浓度的大小关系的知识。
本题难度:困难