时间:2017-11-11 04:03:20
1、选择题 两种金属A与B和稀硫酸组成原电池时,A是正极。下列有关推断正确的是
A.A的金属性强于B
B.电子不断由A电极经外电路流向B电极
C.A电极上发生的电极反应是还原反应
D.A的金属活动性一定排在氢前面
参考答案:C
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。两种金属A与B和稀硫酸组成原电池时,A是正极,这说明金属性是B强于A,A不正确;电子不断由B电极经外电路流向A电极,B不正确;正极导电电子,发生还原反应,选项C正确;A的金属活动性不一定排在氢前面,选项D不正确,答案选C。
点评:该题是基础性试题的考查,难度不大。明确原电池的工作原理是答题的关键,有利于培养学生的逻辑推理能力和发散思维能力。易错点是选项D。
本题难度:简单
2、填空题 (10分)如图所示:已知甲池的总反应式为:2CH3OH+3O2+4KOH?2K2CO3+6H2O
(1)请回答图中甲、乙两池的名称。甲池是?装置,乙池是?装置。
(2)B(石墨)电极的名称是?。在图中标明电子移动的方向。
(3)通入O2的电极的电极反应式是?。
(4)乙池中反应的化学方程式为?。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2?mL(标准状况下)
参考答案:(14分)(1)原电池(化学能转变成电能)?电解池(电能转变成化学能)(2)阳极
(3)O2+2H2O+4e-=4OH-
(4)4AgNO3+2H2O 4Ag+4HNO3+O2↑?(5)280
4Ag+4HNO3+O2↑?(5)280
本题解析:(1)根据装置可知,甲是原电池,乙是电解池。
(2)原电池中负极失去电子,正极得到电子。所以甲中通入甲醇的是负极,通入氧气的是正极。则B是阳极。电子从原电池的负极经导线传递到电解池的阴极,从电解池的阳极经导线传递到原电池的正极。
(3)氧气得到电子,电极反应式为O2+2H2O+4e-=4OH-。
(4)乙中阴极氢离子放电生成氢气,阳极是银离子放电生成银,所以总反应式为
4AgNO3+2H2O 4Ag+4HNO3+O2↑。
4Ag+4HNO3+O2↑。
(5)铁电极形成的是银,物质的量是5.40g÷108g.mol=0.05mol,转移电子是0.05mol,所以根据电子得失守恒可知,消耗氧气是0.05mol÷4=0.0125mol,标准状况下的体积是0.0125mol×22.4L/mol=0.280L=280ml。
本题难度:一般
3、选择题 关于锌、铜和稀硫酸构成的原电池,下列说法中正确的是
[? ]
A.锌是负极、铜是正极
B.电子从铜片经导线流向锌片
C.负极的反应式为2H++2e- = H2↑
D.反应一段时间后,溶液的pH升高
参考答案:AD
本题解析:
本题难度:一般
4、选择题 下列反应中不可能设计成原电池的是( )
A.NaOH+HCl===NaCl+H2O
B.2Fe3++Fe===3Fe2+
C.Zn+2HCl===ZnCl2+H2↑
D.4Al+3O2+6H2O===4Al(OH)3↓
参考答案:A
本题解析:只有氧化还原反应才能设计成原电池,据此可知选项BCD都可以设计成原电池,A是中和反应,不是氧化还原反应,不能设计成原电池,答案选A。
点评:该题主要是考查学生对原电池原理的熟悉了解程度,意在检验学生灵活运用基础知识解决实际问题的能力。该题的关键是明确原电池的构成条件,并能结合题意灵活运用即可。
本题难度:简单
5、填空题 (14分)(1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g) 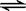 4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,则:υ(NO2)为 、5min时,N2O5占混合气体体积分数是 。
4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,则:υ(NO2)为 、5min时,N2O5占混合气体体积分数是 。
阅读资料,回答(2)、(3)小题
锌铜原电池用画图的方式(如图)表示很不方便,常常采用电池图式表达式,如Zn|ZnSO4(1mol/L)||CuSO4(1mol/L)|Cu 上式中,发生氧化反应的负极写在左边,发生还原反应的正极写在右边。用实垂线“|”表示电极与溶液之间的界面,用双实垂线“||”表示盐桥。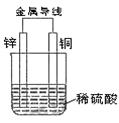
(2)上述资料列举的电池中,锌片上发生的电极反应式是 ,
(3)现有一电池,其图式表达式为Cu|CuSO4(1mol/L)||Fe2(SO4)3(0.5mol/L)|C。该电池中,正极的电极反应式是 ,负极的电极反应式是 。
(4)写出支链只有一个乙基且式量最小的烷烃的结构简式
参考答案:(共14分)
(1) υ(NO2)="0" .16mol/(L·min )(2分) 61.5% (3分)
)(2分) 61.5% (3分)
(2)Zn-2e-=Zn2+(2分)
(3)2Fe3++2e-=2Fe2+(2分) Cu-2e-=Cu2+(2分)
(4)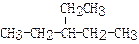 (3分)
(3分)
本题解析:略
本题难度:一般