时间:2017-11-11 04:03:20
1、选择题 下列各个装置中能组成原电池的是
[? ]
A.
B.
C.
D.
参考答案:D
本题解析:
本题难度:简单
2、选择题 研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示) 。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:
负极 ,正极 。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。(填序号)
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3、NO的体积比保持不变
D.每消耗 1 mol SO2,同时生成1 mol NO
当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为 ;
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为 。
参考答案:(1)CO(g)+2H2(g)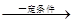 CH3OH(g)
CH3OH(g)
(2)负极:2CH3OH-12e-+2H2O 2CO2+12H+ 正极:3O2+12e-+12H+ 6H2O
(3) B 2.67(或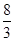 ) (4)1∶7
) (4)1∶7
本题解析:
(1)因为化学反应的过程就是原子重新组合的过程,由于“绿色化学”就是反应物的原子完全转化为目标生成物,所以使用CO、H2来制取CH3OH 。反应的方程式为:CO(g)+2H2(g)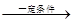 CH3OH(g)。(2)左边通入甲醇的电极为负极,电极反应为:2CH3OH-12e-+2H2O=2CO2+12H+;右边通入O2的电极为正极,由于是酸性介质,发生的电极反应为:3O2+12e-+12H+=6H2O。(3)NO2和SO2反应生成SO3(g)和NO的方程式为:NO2+SO2
CH3OH(g)。(2)左边通入甲醇的电极为负极,电极反应为:2CH3OH-12e-+2H2O=2CO2+12H+;右边通入O2的电极为正极,由于是酸性介质,发生的电极反应为:3O2+12e-+12H+=6H2O。(3)NO2和SO2反应生成SO3(g)和NO的方程式为:NO2+SO2 SO3(g)+NO.A.该反应是反应前后气体体积相等的可逆反应,所以无论反应是否达到平衡,反应的压强都不会发生变化。B.由于容器的容积不变,若反应达到平衡,任何物质的物质的量不变,NO2是有色的物质,其浓度不变,所以混合气体颜色保持不变。因此该反应达到平衡。正确。C.发生反应NO2+SO2
SO3(g)+NO.A.该反应是反应前后气体体积相等的可逆反应,所以无论反应是否达到平衡,反应的压强都不会发生变化。B.由于容器的容积不变,若反应达到平衡,任何物质的物质的量不变,NO2是有色的物质,其浓度不变,所以混合气体颜色保持不变。因此该反应达到平衡。正确。C.发生反应NO2+SO2 SO3(g)+NO ,每产生SO31mol,必然同时产生NO1mol。因此无论反应是否达到平衡,SO3、NO的体积比始终保持不变。故不能作为反应达到平衡的标志。错误。D.SO2是反应物,NO为生成物,方程式中二者的物质的量的比为1:1,所以每消耗 1 mol SO2,同时生成1 mol NO ,与反应是否达到平衡无关,因此不能作为反应达到平衡的标志。错误。假设反应开始时,n(NO2)="amol;" n(SO2)=2amol.。在反应过程中?n(NO2)="xmol" ,则?n(SO2)=xmol,则达到平衡是反应NO2+SO2
SO3(g)+NO ,每产生SO31mol,必然同时产生NO1mol。因此无论反应是否达到平衡,SO3、NO的体积比始终保持不变。故不能作为反应达到平衡的标志。错误。D.SO2是反应物,NO为生成物,方程式中二者的物质的量的比为1:1,所以每消耗 1 mol SO2,同时生成1 mol NO ,与反应是否达到平衡无关,因此不能作为反应达到平衡的标志。错误。假设反应开始时,n(NO2)="amol;" n(SO2)=2amol.。在反应过程中?n(NO2)="xmol" ,则?n(SO2)=xmol,则达到平衡是反应NO2+SO2 SO3(g)+NO平衡体系中n(NO2)=(a-x)mol;n(SO2)=(2a-x)mol;n(SO3)=xmol;n(NO)=xmol。由于平衡时NO2与SO2体积比为1:6,所以(a-x):(2a-x)=1:6.解得
SO3(g)+NO平衡体系中n(NO2)=(a-x)mol;n(SO2)=(2a-x)mol;n(SO3)=xmol;n(NO)=xmol。由于平衡时NO2与SO2体积比为1:6,所以(a-x):(2a-x)=1:6.解得 .所以在该温度下该反应平衡常数
.所以在该温度下该反应平衡常数 。(4)由方程式可以看出:每产生1mol的CO2,消耗混合气体2mol。现在产生2.24L标志状况下的CO2,即产生0.1 mol CO2,所以消耗气体0.1mol..则混合气体的摩尔质量为44g/mol.假设NO为xmol, NO2为(1-x)mol.30x+46(1-x)=44.则x:(1-x)=1:7.
。(4)由方程式可以看出:每产生1mol的CO2,消耗混合气体2mol。现在产生2.24L标志状况下的CO2,即产生0.1 mol CO2,所以消耗气体0.1mol..则混合气体的摩尔质量为44g/mol.假设NO为xmol, NO2为(1-x)mol.30x+46(1-x)=44.则x:(1-x)=1:7.
本题难度:一般
3、选择题 某原电池的总反应的离子方程式是:Zn+Cu2+=Zn2++Cu,此反应的原电池的正确
| ? | 正极 | 负极 | 电解质溶液 |
| A | Cu | Zn | CuCl2 |
| B | Zn | Cu | H2SO4 |
| C | Cu | Zn | CuSO4 |
| D | Cu | Zn | ZnCl2 参考答案:AC 本题解析:考查原电池的判断。原电池中较活泼的金属作负极,失去电子,发生氧化反应。不活泼的金属作正极。根据总反应式可判断,锌是还原剂,铜离子得到电子,被还原,发生还原反应。所以正确的答案是AC。 本题难度:一般 4、填空题 北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6). 参考答案:(1)124.2 本题解析: 本题难度:一般 5、选择题 镁条和铝片为电极,并用导线连接同时插入NaOH溶液中,下列说法正确的是 |
参考答案:B
本题解析:
因为镁条和铝片两种电极中,铝片可以与NaOH溶液反应,而镁片不能与NaOH溶液反应,因而铝片做负极,而镁片作正极,总反应为2Al+2OH-+2H2O=2AlO2-+3H2↑。
A、因为铝片可以与NaOH溶液反应,而镁片不能与NaOH溶液反应,因而铝片做负极,而镁片作正极,故A不正确;
B、根据总反应2Al+2OH-+2H2O=2AlO2-+3H2↑,可以写出其负极的电极反应为:2Al+8OH--6e--=2AlO2-+4H2O,即Al+4OH--3e-=AlO2-+2H2O,故B正确;
C、电流的方向是从正极流向负极,即从Mg电极沿导线流向Al电极,故C不正确;
D、正极镁片上的电极反应为6H2O+6e-=3H2↑+6OH-,故镁片上有气泡产生,故D不正确。
考点:考查原电池的工作原理
点评:本题考查了原电池的工作原理,难度中等。本题考查的原电池的负正极的判断比较特殊,是易错点,不能只根据金属的活泼性来判断,而应结合具体的反应才能确定。
本题难度:一般