时间:2017-11-11 04:03:20
1、填空题 (11分)设计燃料电池使汽油氧化直接产生电流,是本世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答下列问题:
(1)以辛烷(C8H18)为汽油的代表物,则这个电池放电时必发生反应的化学方程式是 。
(2)这个电池负极的电极反应式为C8H18 + 25O2- =8CO2 + 9H2O +50e-,,正极的电极反应式为 ,固体电解质里O2-的移动方向是 。
(3)用此电池分别电解以下两种溶液,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,试回答下列问题。
①电解M(NO3)x溶液时某一电极增加了 g M,则金属M的相对原子质量
g M,则金属M的相对原子质量
(用含“ 、x”的表达式表示)。
、x”的表达式表示)。
②电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100mL,阳极产生的气体在标准状况下的体积是 ;将电解后的溶液加水稀释至1L,此时溶液的c(H+)= 。
参考答案:(1)2C8H18 + 25O2 = 16CO2 + 18H2O (2)O2 + 4e- = 2O2-;由正极流向负极
(3)①ax/0.02 ②0.168L 0.01mol/L
本题解析:略
本题难度:简单
2、选择题 关于锌、铜和稀H2SO4构成的原电池的下列说法中正确的是
A.锌溶解的速率比锌直接与同浓度硫酸反应快
B.电子从铜片经导线流向锌片
C.负极的反应式为2H++2e-===H2↑
D.反应一段时间后,溶液的pH降低
参考答案:A
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,锌是负极,铜是正极,溶液中的氢离子得到电子,所以选项A正确,其余都是错误的,答案选A。
本题难度:简单
3、选择题 下图是一种燃料型电池检测仪的工作原理示意图。下列说法不正确的是?(?)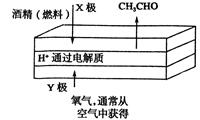
A.该仪器工作时酒精浓度越大,则电流强度越大
B.工作时处电路电子流向为X→Y
C.检测结束后,X极区的pH增大
D.电池总反应为2CH3CH2OH+O2=2CH3CHO+2H2O
参考答案:C
本题解析:A、该图为酒精燃料电池,该仪器工作时酒精浓度越大,则单位时间内转移电子数越多,电流强度越大,正确;B、燃料电池中通入燃料的一极发生氧化反应作原电池的负极,所以X是负极,Y是正极,电子从外电路的负极流向正极,正确;C、酒精发生氧化反应生成乙醛和氢离子,所以X极区的氢离子浓度增大,pH减小,错误;D、燃料电池的反应的实质就是乙醇与氧气反应生成乙醛和水,所以电池总反应为2CH3CH2OH+O2=2CH3CHO+2H2O,正确,答案选C。
本题难度:一般
4、简答题 阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2═2H2O.试回答下列问题:
(1)若电解质溶液为KOH溶液,构成燃料电池,则:
①负极反应式为______
②正极反应式为______
③工作一段时间后,溶液pH______(填“增大”或“减小”或“不变”)
(2)如把KOH改为稀H2SO4作电解质,则:
①负极反应式为______
②正极反应式为______
③工作一段时间后,溶液pH______(填“增大”或“减小”或“不变”).
(3)如把H2改为甲烷,KOH作电解质,则正极反应式为______.
参考答案:(1)①该反应中氢气失电子被氧化,氢气失电子生成氢离子,氢离子和溶液中的氢氧根离子生成水,所以电极反应式为2H2+4OH--4e-=4H2O.
②氧气得电子被还原,氧气得电子和水反应生成氢氧根离子,所以电极反应式为O2+2H2O+4e-=4OH-.
③随着反应的进行,生成的水越来越多,溶质氢氧化钾的量不变,所以导致溶液的浓度降低,所以溶液的PH值减小.
故答案为:①2H2+4OH--4e-=4H2O;②O2+2H2O+4e-=4OH-; ③减小.
(2)该反应中氢气失电子被氧化,氢气失电子生成氢离子,所以电极反应式为2H2-4e-═4H+
②氧气得电子被还原,氧气得电子和溶液中的氢离子生成水,所以电极反应式为O2+4H++4e-═2H2O;
③随着反应的进行,生成的水越来越多,溶质硫酸的量不变,所以导致溶液的浓度降低,所以溶液的PH值增大.
故答案为:①2H2-4e-═4H+;②O2+4H++4e-═2H2O;③增大.
(3)负极上甲烷燃烧生成二氧化碳和水,甲烷失电子发生氧化反应生成二氧化碳,二氧化碳和溶液中的氢氧化钾反应生成碳酸钾和水;
正极上氧气得电子和水反应生成氢氧根离子,所以电极反应式为.O2+2H2O+4e-═4OH-.
故答案为:O2+2H2O+4e-═4OH-.
本题解析:
本题难度:一般
5、填空题 (8分)由A、B、C、D四种金属按下表中装置进行实验。
| 装置 | (Ⅰ)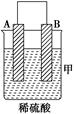 | (Ⅱ)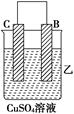 | (Ⅲ)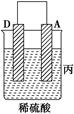 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
参考答案:(1)A-2e-===A2+ (2)Cu2++2e-==="Cu" (3)变大 (4)D>A>B>C
本题解析:(1)二价金属A不断溶解,这说明A电极是负极,所以电极反应式是A-2e-===A2+。
(2)C的质量增加,上面C电极是正极,溶液中的铜离子放电析出铜单质,所以正极反应式是Cu2++2e-===Cu。
(3)A上有气体产生,所以A是原电池的正极,溶液中的氢离子放电,因此溶液的pH增大。
(4)由于在原电池中,较活泼的金属作负极,不活泼的金属作正极。因此四种金属活泼性由强到弱的顺序是D>A>B>C。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以判断原电池的正负极。
本题难度:一般