时间:2017-11-11 03:31:15
1、选择题 下列关于室温下氨水的叙述,正确的是( )
A.同pH同体积的氨水和NaOH溶液,能分别与同浓度同体积的盐酸恰好完全中和
B.加水稀释0.10 mol?L-1的氨水,溶液中n(OH-)减小
C.若温度不变,在氨水中加入少量NH4Cl固体,氨水的电离度和电离平衡常数均变小
D.氨水中的离子浓度关系满足:[OH-]=[H+]+[NH4+]
2、选择题 已知0.1 mol/L的醋酸溶液中存在电离平衡:? CH3COOH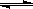 CH3COO-+H+?要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是(? )。
CH3COO-+H+?要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是(? )。
A.加少量CH3COONH4固体
B.降低温度
C.加少量NaOH固体
D.加水稀释
3、选择题 下列物质中,属于强电解质的是
A.CO2
B.盐酸
C.BaSO4
D.NaOH溶液
4、选择题 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )
A.在0点时,醋酸不导电
B.a、b、c三点,a点时醋酸溶液中H+浓度最小
C.b点时,醋酸电离程度最大
D.可通过微热的方法使c点溶液中c(CH3COO-)增大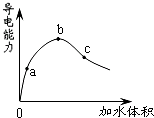
5、填空题 25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
A___________________________________________________;
B____________________________________________________;
C___________________________________________________。
(2)溶液中共有______________种不同的粒子。
(3)在这些粒子中,浓度为0.01mol/L的是 ?;浓度为0.002mol/L的是?。
(4)??和??两种粒子物质的量之和等于0.01mol。