时间:2017-11-11 03:31:15
1、选择题 室温下有下列四种溶液:①0.1 mol/L氨水?②0.1 mol/L NH4Cl溶液?③混合溶液:盐酸和NH4Cl的浓度均为0.1 mol/L?④混合溶液:NaOH和氨水的浓度均为0.1 mol/L。四种溶液中c(NH4+)由大到小排列正确的是
A.②③④①
B.②①③④
C.③②④①
D.③②①④
参考答案:D
本题解析:氨水是弱碱,存在电离平衡;氯化铵是强电解质,完全电离,但氯化铵水解显酸性;盐酸的存在能抑制氯化铵水解;氢氧化钠的存在,能抑制氨水的电离,所以答案选D。
本题难度:一般
2、选择题 下列说法正确的是:
A.室温下,pH=3的盐酸和pH=11的氨水等体积混合后的溶液pH<7
B.室温下,V1LpH=3的硫酸与V2LpH=11的NaOH溶液混合后,若混合溶液的pH=4,则V1:V2=11:9
C.0.1mol·L-1醋酸的pH=a,0.01mol·L-1醋酸的pH= b,则a+1<b
D.在澄清石灰水中通入二氧化碳至过量,溶液的导电能力逐渐减小
参考答案:B
本题解析:A中氨水是弱碱,其浓度大于盐酸的,所以氨水过量,溶液显碱性,不正确。醋酸是弱酸,将0.1mol/L的醋酸稀释10倍,其pH变化小于1个单位,即a+1大于b,C不正确。D中先生成碳酸钙沉淀,然后碳酸钙又溶解生成碳酸氢钙,所以导电能力先减小后增大,D不正确,所以正确的答案选B。
本题难度:简单
3、选择题 某化学兴趣小组在家中进行化学实验,按照图甲连接好线路发现灯泡不亮,按照图乙连接好线路发现灯泡亮,由此得出的结论正确的是( )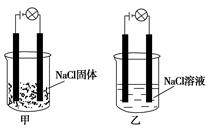
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl是弱电解质
D.NaCl在水溶液中电离出了可以自由移动的离子
参考答案:D
本题解析:电解质概念是对于化合物而言,化合物首先是纯净物,故选项B错;氯化钠为强电解质,在水中能电离出钠离子和氯离子,故选项A、C错,D正确。
本题难度:一般
4、选择题 下列物质的水溶液能导电,但属于非电解质的是
A.HNO3
B.SO2
C.NaHCO3
D.Cl2
参考答案:B
本题解析:分析:电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物.
解答:A.HNO3在水中能电离,则其水溶液导电,即HNO3属于电解质,故A错误;
B.SO2的水溶液能导电,是因SO2和水反应生成亚硫酸,亚硫酸电离生成离子而导电,即发生电离不是SO2本身,故SO2属于非电解质,故B正确;
C.因NaHCO3在水溶液或熔化状态下都能导电,则NaHCO3属于电解质,故C错误;
D.因非电解质是化合物,而Cl2是单质,即Cl2既不是电解质也不是非电解质,故D错误.
故选B.
点评:本题考查电解质和非电解质,难度不大,学生应明确电解质和非电解质都是化合物,并明确判断电解质时发生电离的为化合物本身来分析解答即可.
本题难度:困难
5、选择题 下列叙述正确的是( )
A.0.1?mol?L-1醋酸溶液中:c(H+)=c(CH3COO-?)+c(OH-?)
B.中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者
C.同温度同浓度的NaOH和澄清石灰水中,水的电离程度相同
D.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-)>c(H+)
参考答案:AB
本题解析:
本题难度:一般