时间:2017-11-11 03:00:15
1、填空题 下面是元素周期表的一部分,表中所列字母分别代表某一化学元素.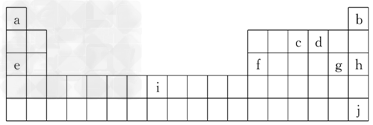
(1)NH3·H2O的电离方程式NH3·H2O NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构________(填字母代号).
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构________(填字母代号).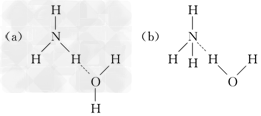
(2)上表中的c原子间也可形成链状结构,假设c原子间只以单键形式连接,并形成与直链烷烃类似的氢化物,则该系列氢化物的通式为_________________________________.
(3)利用稀有气体化合物,人们实现了许多制备实验上的突破.如用j的+6价氧化物在碱性条件下与NaBrO3反应生成NaBrO4,同时生成j的单质.写出上述反应的方程式_________________________________________________.
(4)若已知原子结构规律不变,则第166号新元素在元素周期表中位置:______________.
参考答案:(1)b
(2)NnHn+2
(3)3NaBrO3+XeO3===3NaBrO4+Xe
(4)第八周期ⅥA族
本题解析:
本题难度:一般
2、选择题 下列关于性质递变规律的叙述不正确的是( )
A.还原性:Na>Mg>Al>S
B.氧化性:F>Cl>S>P
C.酸性:H2CO3<H3PO4<H2SO4<HClO
D.稳定性:SiH4<PH3<NH3<H2O
参考答案:A、Na、Mg、Al、S为同周期元素,从左向右金属性减弱,则还原性为Na>Mg>Al>S,故A正确;
B、同周期元素,从左向右非金属性增强,则Cl>S>P,同主族从上到下非金属性减弱,则氧化性F>Cl>S>P,故B正确;
C、HClO为弱酸,非金属性越强,最高价氧化物对应水化物的酸性为H2CO3<H3PO4<H2SO4<HClO4,,故C错误;
D、非金属性O>N>P>Si,对应的气态氢化物稳定性为SiH4<PH3<NH3<H2O,故D正确;
故选C.
本题解析:
本题难度:简单
3、推断题 A、B、C、D为原子序数小于18的四种元素:A原子的电子层数等于最外层电子数;A与B处于同一周期,B与D 可形成离子化合物D2B,该化合物在水溶液中水解显碱性;C的离子核内质子数与核外电子数之和为18;A、C、D 三种元素的离子具有相同的电子层结构。根据上述信息回答下列问题:
(1)写出元素B的元素符号_________,元素B的氢化物的空间构型为__________。
(2)写出D原子形成简单离子的电子排布式________________。
(3)四种元素离子半径的大小顺序为__________,第一电离能最小的是__________。
(4)C的双原子单质分子中含有____个σ键和______个π键,元素C的三原子氢化物中,中心原子C的杂化方式为____________。
(5)元素A和C形成的化合物熔点高,硬度大,工业上常采用电解熔融该化合物的方法来制备单质A。由此 可推断A、C形成的化合物为__________晶体。
参考答案:(1)S;v形(或角形)
(2)1s22s22p6
(3)r(S2-)>r(O2-)>r(Na+)>r(Al3+);Na
(4)1;1;sp3
(5)离子
本题解析:
本题难度:一般
4、选择题 A、B两种元素以共价键相结合成AB2型化合物,则A、B两种元素在周期表中的族不可能是下列的
A.ⅣA、ⅥA
B.ⅥA?、ⅦA?
C.VA、ⅥA
D.ⅡA、ⅦA
参考答案:D
本题解析:非金属元素的原子间形成共价键,所以以共价键相结合成AB2型化合物可以是CO2、SO2、NO2、OF2等。第ⅡA是金属元素,不能形成共价键,答案选D。
本题难度:一般
5、选择题 IUPAC推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法不正确的是
[? ]
A.Ds原子的电子层数为7?
B.Ds是超铀元素
C.Ds原子的质量数为110?
D.Ds为金属元素
参考答案:C
本题解析:
本题难度:简单