时间:2017-11-11 03:00:15
1、推断题 四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。 
(1)写出B原子的电子排布式____________。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点________(填“高”或“低”),其原因是____________________。
(3)D元素的某价态阳离子可与KCN溶液形成一种俗称黄血盐的配合物甲,甲的化学式可表示为
K4[D(CN)6],则中心原子D的化合价为________,甲在水溶液中的电离方程式为____________________;已知D元素的另一种价态的离子可与KCN溶液形成另一种配合物乙,乙的配位数与甲相同,则乙的化学式为____________。
(4)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“o”表示氢原子,小黑点表示没有形成共价键的最外层电子,短线表示共价键。 
则在以上分子中,中心原子没有采用sp3杂化形成化学键的是________(填写序号);在②的分子中有
____个σ键
参考答案:(1)1s22s22p63s23p4
(2)高;因为A的氢化物分子间存在氢键
(3)+2;K4[Fe(CN)6]=4K++[Fe(CN)6]4-;K3[Fe(CN)6]
(4)②;3
本题解析:
本题难度:一般
2、选择题 13C-NMR(核磁共振)可用于含碳化合物的结构分析14N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关13C、15N叙述正确的是
A.13C与15N具有相同的中子数
B.13C与C60是同一种物质
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
参考答案:C
本题解析:试题分析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。又因为质子数和中子数之和是质量数,所以A中13C与15N的中子数分别是67、8,A不正确;具有一定数目质子和一定数目中子的一种原子是核素,即13C是一种核素,而C60是一种单质,B不正确。质子数相同,中子数不同的同一种元素的不同核素互称为同位素,所以选项C正确。15N的核外电子数与中子数分别是7和8,D不正确,答案选A。
考点:考查同位素、核素以及原子组成的有关判断和计算
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固和训练。该题的关键是明确同位素、核素的含义以及原子组成的表示方法,并能灵活运用即可。
本题难度:困难
3、选择题 下列有关物质性质的比较正确的是:
A.熔点、沸点:F2﹥Cl2﹥Br2﹥I2
B.离子半径:F-﹥Na+﹥Mg2+﹥Al3+
C.碱性:LiOH﹥NaOH﹥KOH﹥RbOH
D.Na2CO3水溶液中:c(Na+)﹥c(CO32-)﹥c(HCO3-)﹥c(OH-)﹥c(H+)
参考答案:B
本题解析:
本题难度:困难
4、选择题 因周期表中过渡金属元素性质递变规律并不明显,可将其省略从而得到一张新的周期表.现有前三周期元素A、B、C,它们在该新周期表中的相对位置如图,下列说法正确的是( )
A.若A原子的最外层电子数比电子层数少1,则C的一种氧化物可以使品红溶液褪色
B.若A的单质能与无水乙醇反应,则B的氧化物一定为酸性氧化物
C.若A的氧化物为酸性氧化物,则B的最高价氧化物的水化物为强酸
D.若A的氧化物可以与强酸、强碱反应,则氢化物的熔沸点C比B高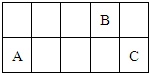
参考答案:根据元素在周期表中的位置知,A和C位于第三周期,B位于第二周期,
A.若A原子的最外层电子数比电子层数少1,则A为Mg元素,C为S元素,二氧化硫具有漂白性,能使品红溶液褪色,故A正确;
B.若A的单质能与无水乙醇反应,则A为Na元素,B为C元素,CO为不成盐氧化物,故B错误;
C.若A的氧化物为酸性氧化物,则A为Si元素,则B为F元素,F是非金属性最强的元素,没有最高价氧化物的水化物,故C错误;
D.若A的氧化物可以与强酸、强碱反应,则A是Al元素,C为Cl元素,B为O元素,水中含有氢键,氯化氢中不含氢键,氢键的存在导致水的沸点大于氯化氢,故D错误;
故选A.
本题解析:
本题难度:简单
5、推断题 现有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p轨道电子数比s轨道电子数少1,C为金属元素且原子核外p轨道电子数和s轨道电子数相等,D元素的原子核外所有p轨道全充满或半充满。
(1)写出四种元素的元素符号: A____,B____,C____,D______。
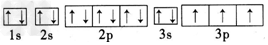
(2)写出C、D两种元素基态原子核外电子排布的轨道表示式:C____; D____。
(3)写出B、C两种元素的单质在一定条件下反应的化学方程式____________________。
(4)写出B元素单质和氢化物的电子式:单质____,氢化物________。
参考答案:(1)H;N;Mg;P
(2)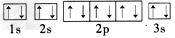 ;
;
(3)N2+3Mg Mg3N2
Mg3N2
(4) ;
;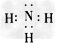
本题解析:
本题难度:一般