时间:2017-11-11 02:28:57
1、选择题 下列叙述正确的是?(?)
A.某电解质溶于水后,其导电能力不强,则此电解质必定是弱电解质
B.SO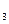 溶于水后,所得溶液导电性很好,故SO
溶于水后,所得溶液导电性很好,故SO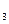 是强电解质
是强电解质
C.共价化合物都是弱电解质
D.弱电解质溶液中,同时存在着电解质电离出来的离子及未电离的分子
参考答案:D
本题解析:略
本题难度:一般
2、选择题 在下列叙述中,不能说明醋酸是弱电解质的是
A.室温下,0.1mol·L-1的CH3COONa溶液的pH=8
B.室温下,0.1mol·L-1的CH3COOH溶液的pH="3"
C.醋酸中加水后,溶液的pH升高
D.0.1mol·L-1的CH3COOH导电能力不如0.1mol·L-1的盐酸强
参考答案:C
本题解析:A正确,CH3COONa为盐,溶液的pH=8为碱性,所以该盐为强碱弱酸盐,醋酸为弱酸;B正确,如醋酸为强酸,则溶液的pH=1,当此时溶液的pH=3即醋酸为弱酸;C错,醋酸加水后,氢离子浓度降低,溶液的PH升高,但不一定是说明醋酸是弱酸;D正确,溶液的导电能力与溶液中的自由移动的离子浓度大小有关;
本题难度:一般
3、选择题 常温下,对于0.1 mol.L-1pH= 10的Na2CO3溶液,下列说法正确的是
A.通入CO2,溶液pH减小
B.加入NaOH固体,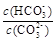 增大
增大
C.由水电离的c(OH-) = 1×10-10 mol.L-1
D.溶液中:c(CO32-)>c(OH-)>c(HCO3-)
参考答案:AD
本题解析:CO32-+H2O≒HCO3-+OH-,A.当通入二氧化碳后,二氧化碳与水反应生成碳酸,PH值减小,正确;当加入NaOH固体,水解平衡向逆进行,c(HCO3-)减小,c(CO32-)增大,它们的比值减小,错误;C. pH= 10可计算得到c(H+) = 1×10-10 mol.L-1而c(OH-) = 1×10-4 mol.L-1,这个c(OH-)就是水电离出来的,错误;D.溶液中存在CO32-+H2O≒HCO3-+OH-,H2O≒H++OH-,由于水解相对弱,所以此项正确。
本题难度:一般
4、选择题 下列叙述错误的是? (? )
A.把a L0.1 mol/L的CH3COOH溶液与b L0.1 mol/L的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c(CH3COO一)+c(OH一)
B.把0.1 mol/L的NaHC03溶液与0.3 mol/L的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH一)>c(Ba2+)>c(Na+)>c(H+)
C.向1 mol/L的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高
D.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同
参考答案:C
本题解析:A、根据电荷守恒可得:c(K+)+c(H+)=c(CH3COO一)+c(OH一),正确;B、0.1 mol/L的NaHC03溶液与0.3 mol/L的Ba(OH)2溶液等体积混合,发生反应:HCO3?+Ba2++OH?=BaCO3↓+H2O,所得溶液中一定存在:c(OH一)>c(Ba2+)>c(Na+)>c(H+),正确;C、向1 mol/L的CH3COOH溶液中加入少量CH3COONa固体,CH3COO?的浓度增大,CH3COOH的电离平衡向左移动,所以溶液的pH升高,错误;D、常温下, pH=3的CH3COOH溶液,CH3COOH电离出的H+浓度为0.001mol?L?1,pH=11的NaOH溶液,NaOH电离出的OH?为0.001mol?L?1,对水的电离抑制作用相同,正确。
本题难度:一般
5、选择题 在体积均为1 L,pH均等于2的盐酸和醋酸中,分别投入0.12 g镁粉充分反应后,下图中比较符合反应事实的曲线是( )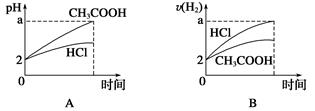
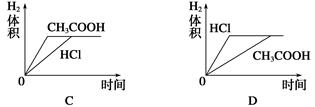
参考答案:C
本题解析:镁最多失去电子的物质的量为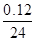 ×2=0.01 mol。A、B项,在反应过程中,CH3COOH进一步电离,CH3COOH的pH小于HCl的pH,生成氢气的速率,v(CH3COOH)>v(HCl),A、B均错;C、D项,由于Mg是定量的,HCl恰好完全反应,而CH3COOH过量,且CH3COOH与Mg反应速率快,所以C对,D错。
×2=0.01 mol。A、B项,在反应过程中,CH3COOH进一步电离,CH3COOH的pH小于HCl的pH,生成氢气的速率,v(CH3COOH)>v(HCl),A、B均错;C、D项,由于Mg是定量的,HCl恰好完全反应,而CH3COOH过量,且CH3COOH与Mg反应速率快,所以C对,D错。
本题难度:简单