时间:2017-11-11 02:28:57
1、填空题 完全中和9.8g三元含氧酸酸H3AO4,消耗氢氧化钠12g,此三元酸物质的量是__?______,相对分子质量是_____?__.已知该酸是弱酸,请用其实际化学式分三步写出电离方程式?。
参考答案:0.1mol? 98? H3PO4=H++H2PO4-? H2PO4-=H++ HPO42-? HPO42-=H++PO43-
本题解析:略
本题难度:简单
2、选择题 氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A.1mol/L氢氰酸溶液的pH约为3
B.HCN易溶于水
C.10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应
D.HCN溶液的导电性比强酸溶液的弱
参考答案:A
本题解析:A可以,常温下,如果HCN是强电解质,1mol/LHCN溶液,PH应该等于0
B错误,溶解性与电解质强弱没有直接关系。
C错误,恰好完全反应并没有说明溶液的酸碱性情况。
D错误,导电能力强弱与电解质强弱无直接关系。
本题难度:一般
3、选择题 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与体积(v)的关系如图所示,则下列说法正确的是( )
A.A、B两种酸溶液物质的量浓度一定相等
B.稀释后A酸溶液的酸性比B酸溶液强
C.若a=5,则A是强酸,B是弱酸
D.若A.B都是弱酸,则2<a<5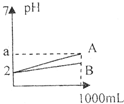
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列比较中,正确的是?
A.等温等物质的量浓度溶液中,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B.0.2 mol/L NH4Cl溶液和0.1 mol/LNaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)= c(S2-)+ c(HS-)+ c(H2S)
D.同浓度的下列溶液中:①NH4Al(SO4) 2②NH4Cl③CH3COONH4④NH3·H2O,c(NH4+)由大到小的顺序是①>②>③>④
参考答案:D
本题解析:A.等温等物质的量浓度溶液中,HF比HCN易电离,HF酸性强强,F-水解程度小,则等温等物质的量浓度溶液中,NaF溶液的pH比NaCN溶液小,说法不正确;B.0.2 mol/L NH4Cl溶液和0.1 mol/LNaOH溶液等体积混合后,溶液中含等浓度的NaCl、NH4Cl和NH3·H2O,有c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),排列顺序错误;C.物质的量浓度相等的H2S和NaHS混合溶液中,因S的物质的量是Na的2倍,故是2c(Na+)= c(S2-)+ c(HS-)+ c(H2S),说法错误。D.同浓度的下列溶液中:①NH4Al(SO4)2,NH4+和Al3+相互抑制水解,②NH4Cl(参考物)③CH3COONH4,NH4+和CH3COO-相互促进水解④NH3·H2O为弱电解质,部分电离,故c(NH4+)由大到小的顺序是①>②>③>④正确。
本题难度:一般
5、选择题 在NH3.H2O?NH
参考答案:A.通入氯化氢气体,氯化氢和氢氧根离子反应,促进氨水电离,但氢氧根离子浓度减小,所以不符合题意,故A错误;
B.加入少量氢氧化钠固体,氢氧化钠溶于水电离出氢氧根离子,氢氧根离子浓度增大,但抑制氨水电离,故B错误;
C.加入少量氯化铵固体,氯化铵溶于水电离出铵根离子,抑制氨水电离,使氨水电离程度和氢氧根离子浓度都减小,故C错误;
D.氨水的电离是吸热反应,升高温度促进氨水电离,且氢氧根离子浓度增大,故D正确;
故选D.
本题解析:
本题难度:简单