时间:2017-11-11 01:01:32
1、填空题 利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池。已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1、CH3OH(l)+ 3/2O2(g)= CO2 (g)+ 2H2O(l)?ΔH=-726.5 kJ·mol-1、CO(g) +1/2O2(g)= CO2 (g)?ΔH=-283.0 kJ·mol-1。
请回答下列问题:
⑴用太阳能分解18g水,需要消耗的能量为??kJ。
⑵ 液态CH3OH不完全燃烧生成CO和液态H2O的热化学方程式为?。
⑶CO2合成燃料CH3OH是碳减排的新方向。在容积为2 L的密闭容器中,充2 mol CO2和6 mol H2,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):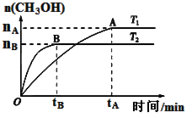
①下列说法正确的是?
A.温度为T2时,从反应开始到平衡,生成甲醇的平均速率为:? v(CH3OH)=nB/tB?mol·(L·min)-1
B.T2>T1,T2平衡时,甲醇产量变少,所以该反应为放热反应
C.该反应在T2时的平衡常数比T1时的平衡常数大
D.处于A点的反应体系从T1变到T2,平衡逆向移动
②能判断该反应已达化学反应限度标志的是?(填字母。
A.H2的百分含量保持不变
B.容器中CO2 浓度与H2浓度之比为1: 3
C.容器中混合气体的密度保持不变
D.CO2消耗速率与CH3OH生成速率相等
⑷科学家致力于CO2的“组合转化”技术研究,如将CO2和H2以体积比1∶4比例混合通入反应器,适当条件下,反应可获得一种能源。完成以下化学方程式,就能知道该种能源。
CO2+4H2 2H2O + ??。
2H2O + ??。
⑸ 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为:2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为?;负极的反应式为?。
2、选择题 燃烧热与反应热的关系是
A.当一个反应是燃烧反应时,该燃烧反应的反应热就是燃烧热
B.燃烧热是反应热的一种类型
C.燃烧热不属于反应热,反应热是在25 ℃、101 kPa下测定的,而燃烧反应的温度要高
D.反应热有正负之分,燃烧热全部是正值
3、选择题 浓度均为0.1mol/L的下列五种溶液①Na2CO3溶液 ②NaOH溶液?③NaHSO4溶液
④NH4Cl溶液 ⑤NaNO3溶液,PH的大小顺序为
A.②﹥①﹥⑤﹥④﹥③
B.②﹥①﹥⑤=③﹥④
C.①﹥②﹥⑤﹥④﹥③
D.②﹥①﹥⑤﹥③﹥④
4、选择题
A.2.4×10-7 mol·L-1
B.0.1×10-7 mol·L-1
C.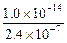 mol·L-1
mol·L-1
D.c(OH-)无法确定
5、选择题 已知:①CH3OH(g)+3/2O2(g) = CO2(g) + 2H2O(g) △H =" a" kJ·mol- 1
②CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) △H =" b" kJ·mol- 1 则下列叙述正确的是
A.C—H键键长小于H—H键
B.甲烷的燃烧热为b kJ·mol -1
C.2CH3OH(g)=2CH4(g)+O2(g)△H=2(a—b) kJ·mol- 1
D.当甲醇和甲烷物质的量之比为l:2时,其完全燃烧生成CO2和H2O(g)时,放出的热量为c kJ,则
该混合物中甲醇的物质的量为c/(a+2b)mol