时间:2017-11-11 01:01:32
1、选择题 常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL 0.1000mol·L-1CH3COOH溶液,滴定曲线如右图。下列说法正确的是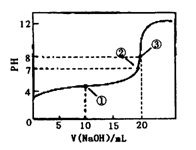
A.点①所示溶液中:[CH3COO-]+[OH-]=[CH3COOH] +[H+]
B.点②所示溶液中:[Na+]=[CH3COOH]+[CH3COO-]
C.点③所示溶液中:[Na+]>[OH-]>[CH3COO-]>[H+]
D.滴定过程中可能出现:[CH3COOH]>[CH3COO-]>
[H+]>[Na+」>[OH-]
参考答案:D
本题解析:A 错误,应遵循电荷守恒,[CH3COO-]+[OH-]=[Na+]+[H+]
B 错误,点②所示溶液PH=7,显中性,[Na+]=[CH3COO-]
C 错误,点③所示溶液中:[Na+]>[CH3COO-]>[OH-]>[H+]
D 正确。在CH3COOH溶液中开始滴入很少量的NaOH溶液时出现此种情况。
本题难度:一般
2、填空题 有人曾建议用AG表示溶液的酸度(acidity grade),AG的定义为
AG=lg(c(H+)/c(OH-))。请回答下列问题:
(1)在25℃时,若溶液呈中性,则AG= ?。
(2)在25℃时,若溶液的pH=12,则AG= ?。
(3)在25℃时,溶液的pH与AG的换算公式为AG= ?(要化简)。
(4)在25℃时,将AG=-12的NaOH溶液aL与AG=12的H2SO4溶液bL混合(混合后的体积误差可以 忽略),若所得混合液的AG=10,则a∶b= ?。
参考答案:(1) 0?(2)-10?(3)14-2pH?(4)9∶11
本题解析:(1)在25℃时,若溶液呈中性,c(H+)=c(OH-)=10-7mol/L.c(H+)/c(OH-)=1.所以AG= lgc(H+)/c(OH-)=0。(2)在25℃时,若溶液的pH=12,则c(H+)=10-12mol/L,c(OH-)=Kw÷c(H+)=10-2mol/Lc(H+)/c(OH-)=10-10.AG=-10.(3)在25℃时,溶液的pH=-lgc(H+), c(OH-)=Kw÷c(H+)=10-14/c(H+);AG=lgc(H+)/c(OH-)=lgc2(H+)/Kw="14+2lg" c(H+)=14-2pH。(4)在25℃时,将AG=-12的NaOH溶液,pH=13,c(OH-)=0.1mol/L与AG=12的H2SO4溶液,pH=1,c(H+)=0.1mol/L两溶液混合后.AG=10,pH=2,c(H+)=0.01mol/L则0.1b-0.1a=0.01(a+b).整理可得a:b=9:11。
本题难度:一般
3、选择题 常温下,0.05 mol/L的Ba(OH)2溶液,pH为
A.13
B.12
C.1l
D.10
参考答案:A
本题解析:
正确答案:A
C(H+)=Kw/c(OH―)=10-14/(0.05×2)=10-13mol/L,?pH=13
本题难度:一般
4、填空题 已知下列热化学方程式:
①H2(g)+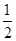 O2(g)=H2O(l)ΔH=-285.8 kJ/mol
O2(g)=H2O(l)ΔH=-285.8 kJ/mol
②H2(g)+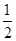 O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+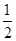 O2(g)=CO(g)ΔH=-110.5 kJ/mol
O2(g)=CO(g)ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g)ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是 。
(2)H2的燃烧热为 ,C的燃烧热为 。
(3)燃烧10 g H2生成液态水,放出的热量为 。
(4)CO的燃烧热为 ,其热化学方程式为 。
参考答案:(1)①②③④
(2)285.8 kJ/mol 393.5 kJ/mol
(3)1 429.0 kJ
(4)283.0 kJ/mol CO(g)+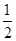 O2(g)=CO2(g) ΔH=-283.0 kJ/mol
O2(g)=CO2(g) ΔH=-283.0 kJ/mol
本题解析:(1)所有燃烧均为放热反应,故①②③④均为放热反应。
(2)燃烧热为1 mol纯物质完全燃烧生成稳定氧化物时放出的热量,H2的燃烧热为285.8 kJ/mol,C的燃烧热为393.5 kJ/mol。
(3)Q放=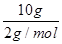 ×285.8 kJ/mol=1 429.0 kJ。
×285.8 kJ/mol=1 429.0 kJ。
(4)由④-③可得,CO(g)+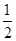 O2(g)=CO2(g)ΔH=-393.5+110.5=-283.0(kJ/mol),
O2(g)=CO2(g)ΔH=-393.5+110.5=-283.0(kJ/mol),
故CO的燃烧热为283.0 kJ/mol。
本题难度:一般
5、选择题 已知下列两个热化学方程式
2H2(g)+O2(g)=2H2O(1) △H= -571.6KJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(1) △H=-2220.0kJ/mol
实验测得,5mol氢气和丙烷的混合气体完全燃烧时放热3847kJ,则混合气体中氢气与丙烷的体积比是
A.1:3
B.3:1
C.1:4
D.1:1
参考答案:B
本题解析:1mol混合气体完全燃烧放热3847kJ/5=769.4kJ,根据十字交叉法,氢气与丙烷的体积比(2220.0-769.4):(769.4-571.6/2)=3:1,答案选B。
考点:热化学方程式的计算
本题难度:一般