时间:2017-11-05 23:49:42
1、选择题 H2SO3是二元弱酸,NaHSO3溶液呈酸性。在0.1 mol/L NaHSO3溶液中,下列关系正确的是
A.c(HSO3-) > c(SO32-) > c(H2SO3)
B.c(Na+) = c(HSO3-) + 2c(SO32-) + c(HSO3)
C.c(Na+) = c(HSO3-) > c(H+) > c(OH-)
D.c(Na+) + c(H+) = c(HSO3-) + c(OH-) + c(SO32-)
参考答案:A
本题解析:NaHSO3溶液呈酸性,表明HSO3-的电离程度大于水解程度,但是电离和水解都比较微弱,所以A对;B项结合物料守恒,应该为c(Na+) = c(HSO3-) + c(SO32-) + c(H2SO3);C项应为c(Na+)>c(HSO3-) > c(H+) > c(OH-);结合电荷守恒可知D项错误,应为c(Na+) + c(H+) = c(HSO3-) + c(OH-) +2 c(SO32-).
考点:离子浓度大小的比较。
本题难度:一般
2、选择题 常温下0.1 mol·L-1氨水的pH=a,下列能使溶液pH=(a+1)的措施是
A.加入适量的氢氧化钠固体
B.将溶液稀释到原体积的 10倍
C.加入等体积0.2 mol·L-1氨水
D.降低溶液的温度
参考答案:A
本题解析:A.加入适量的氢氧化钠固体,可以使溶液中c(OH-)增大,可能使溶液的pH由a→(a+1).正确。B.将溶液稀释到原体积的10倍,溶液的pH减小,不可能变为(a+1)。错误。C.加入等体积0.2 mol·L-1氨水,氨水的浓度为(0.1+0.2)mol/L÷2=0.15mol/L.氨水浓度增大,溶液的pH增大,但是也不可能增大1个单位。错误。D.氨水中的一水合氨是弱电解质。降低温度,电离程度减小,电解质电离的程度越小,溶液中的c(OH-)越小,pH就越小。错误。
考点:考查影响弱电解质电离平衡的因素的知识。
本题难度:一般
3、选择题 醋酸溶液中存在电离平衡:CH3COOH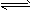 H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
[? ]
A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.1 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
参考答案:B
本题解析:
本题难度:一般
4、选择题 向0.1mol/L CH3COOH溶液中加入CH3COONa晶体或加等体积水稀释时,都会引起
[? ]
A.溶液的pH增大
B.CH3COOH的电离程度增大
C.溶液的导电能力减小
D.溶液的c(OH-)减小
参考答案:A
本题解析:
本题难度:一般
5、选择题 在pH=3的0.1mol/L HA溶液中加入少量KA晶体,不可能发生的变化是
[? ]
A.pH减小
B.A-浓度增大
C.H+减小
D.HA数目增大
参考答案:A
本题解析:
本题难度:一般