时间:2017-11-05 23:49:42
1、填空题 (10分)(1)现有NH4Cl和NH3·H2O组成的混合溶液,若其pH=7,则该溶液中c(NH4+)___c(Cl-);若pH>7,则该溶液中c(NH4+)______c(Cl-)。(填“>”、“<”、“=”).
(2)0.1mol/L的NaHCO3溶液中,按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外) ,c(Na+)+c(H+)=_______________ ,c(Na+)=____________
参考答案:(1)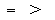 (2)c(Na+)> c(HCO3-)> c(OH-)> c(H2CO3)> c(H+)> c(CO32-)。c(Na+)+ c(H+)= c(HCO3-)+ c(OH-)+2 c(CO32-), c(Na+)= c(HCO3-)+c(H2CO3)+ c(CO32-)。
(2)c(Na+)> c(HCO3-)> c(OH-)> c(H2CO3)> c(H+)> c(CO32-)。c(Na+)+ c(H+)= c(HCO3-)+ c(OH-)+2 c(CO32-), c(Na+)= c(HCO3-)+c(H2CO3)+ c(CO32-)。
本题解析:(1)氯化铵和氨水的混合溶液,若pH=7,说明溶液为中性,即氢离子浓度=氢氧根离子浓度,根据电荷守恒,则铵根离子浓度=氯离子浓度。若pH>7,溶液为碱性,即氢离子浓度<氢氧根离子浓度,根据电荷守恒知铵根离子浓度大于氯离子浓度。(2)碳酸氢钠溶液中存在碳酸氢根电离和水解,水解大于电离,所以离子浓度大小顺序为: c(Na+)> c(HCO3-)> c(OH-)> c(H2CO3)> c(H+)> c(CO32-)。根据电荷守恒知道:c(Na+)+ c(H+)= c(HCO3-)+ c(OH-)+2 c(CO32-),根据物料守恒,即c(Na+)= c(HCO3-)+c(H2CO3)+ c(CO32-)。
考点:溶液中的离子浓度关系。
本题难度:一般
2、选择题 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中正确的是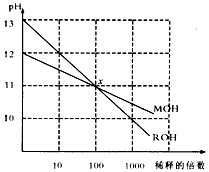
[? ]
A.MOH和ROH都是强碱
B.稀释前,c(ROH)= 10c(MOH)
C.常温下pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性
D.在x点,c(M+)=c(R+)
参考答案:D
本题解析:
本题难度:一般
3、选择题 pH相同的盐酸和醋酸两种溶液中,它们的
[? ]
A.H+的物质的量相同
B.物质的量浓度相同
C.醋酸物质的量浓度大于盐酸
D.H+的物质的量浓度相同
参考答案:CD
本题解析:
本题难度:一般
4、选择题 下列有关说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.醋酸钠溶液中滴加酚酞显红色,证明醋酸为弱电解质
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
D.某温度下,纯水中的c(H+)=1.0×10-6.5mol/L,则该温度下pH=1的盐酸中水电离的c(H+)=1.0×10-12mol/L
参考答案:BD
本题解析:A.CaCO3(s)=CaO(s)+CO2(g)是体系混乱程度增大的反应,在室温下不能自发进行,说明该反应的△H>0,错误;B.醋酸钠是盐,在其溶液中滴加酚酞显红色,证明醋酸钠是强碱弱酸盐,弱酸根离子发生水解反应消耗水电离产生的c(H+),是溶液中c(OH-)> c(H+),所以醋酸为弱电解质,正确;C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)加快;升高温度,根据平衡移动原理,平衡向吸热的方向移动,对该反应来说,平衡逆向移动,所以氢气的平衡转化率减小,错误;D.某温度下,纯水中的c(H+)=1.0×10-6.5mol/L,Kw=1.0×10-13mol2/L2,所以温度高于室温。则该温度下pH=1的盐酸中水电离的c(H+)= c(OH-)=1.0×10-13mol2/L2÷1.0×10-1mol/L=1.0×10-12mol/L,错误。
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)加快;升高温度,根据平衡移动原理,平衡向吸热的方向移动,对该反应来说,平衡逆向移动,所以氢气的平衡转化率减小,错误;D.某温度下,纯水中的c(H+)=1.0×10-6.5mol/L,Kw=1.0×10-13mol2/L2,所以温度高于室温。则该温度下pH=1的盐酸中水电离的c(H+)= c(OH-)=1.0×10-13mol2/L2÷1.0×10-1mol/L=1.0×10-12mol/L,错误。
考点:考查反应的自发性、盐的水解、化学平衡及弱电解质的电离的知识。
本题难度:一般
5、选择题 下列说法正确的是:
A.室温下,pH=3的盐酸和pH=11的氨水等体积混合后的溶液pH<7
B.室温下,V1LpH=3的硫酸与V2LpH=11的NaOH溶液混合后,若混合溶液的pH=4,则V1:V2=11:9
C.0.1mol·L-1醋酸的pH=a,0.01mol·L-1醋酸的pH= b,则a+1<b
D.在澄清石灰水中通入二氧化碳至过量,溶液的导电能力逐渐减小
参考答案:B
本题解析:A中氨水是弱碱,其浓度大于盐酸的,所以氨水过量,溶液显碱性,不正确。醋酸是弱酸,将0.1mol/L的醋酸稀释10倍,其pH变化小于1个单位,即a+1大于b,C不正确。D中先生成碳酸钙沉淀,然后碳酸钙又溶解生成碳酸氢钙,所以导电能力先减小后增大,D不正确,所以正确的答案选B。
本题难度:简单